ACC/AHA PRACTICE GUIDELINES
ACC/AHA 2006 Guidelines for
the
Management of Patients With Valvular Heart Disease
1. ВВЕДЕНИЕ
1.1. Уровни обоснованности и
надежности вмешательств
Пациенты с клапанными пороками сердца – это очень важная и большая категория
пациентов, которая требует подчас сложных диагностических процедур и длительного лечения.
В течение прошлых 2 десятилетий
основные достижения произошли в диагностике как неинвазивной, так и инвазивной
диагностике, и в хирургическом лечении
клапанных пороков сердца. Эти достижения заключались в значительном
уточнении диагноза болезни и в качестве отбора пациентов для хирургического лечения. А также в относительном увеличении катетерных инвазивные вмешательств против медикаментозного лечения и в увеличении выживания пациентов с
клапанными пороками сердца.
Классификация положений рекомендаций с учетом весомости и
доказанности.
Степень обоснованности применения вмешательства:
Класс I. Существуют доказательства и/или общее соглашение, что
процедура или метод лечения полезны и эффективны.
Класс II. Имеются противоречивые данные и/или мнения экспертов о
полезности/ эффективности вмешательства
Класс IIа. Больше доказательств или мнений в пользу вмешательства.
Класс IIb. Целесообразность вмешательства менее очевидна.
Класс III. Существуют доказательства и/или общее соглашение, что
процедура или метод лечения не полезны, не эффективны и в некоторых случаях
могут быть опасными.
Степень надежности доказательств, лежащих в
основе рекомендаций:
Уровень доказанности А (наивысший) – данные
получены во многих рандомизированных клинических исследованиях.
Уровень доказанности В (промежуточный) – данные получены в ограниченном
количестве рандомизированных исследований, нерандомизированных исследованиях
или регистрах, предназначенных для наблюдения.
Уровень доказанности С (низкий) – рекомендации основываются преимущественно на соглашении экспертов.
.
1.2. Содержание документа
Руководство рассматривает общие проблемы диагностики и лечения пациентов
с шумами в области сердца, профилактики и лечения
инфекционного эндокардита, наблюдения и
лечения приобретенных пороков сердца при беременности, диагностики и лечения пациентов с ИБС.
Руководство посвящено в основном клапанным
порокам сердца у взрослых и, отдельно,
клапанным порокам у подростков и детей.
Диагноз и лечение детей с врожденными
пороками сердца не рассматриваются в данном руководстве.
Это руководство повторяет некоторые
положения других руководств ACC/AHA,
в частности руководства о радионуклидных исследованиях (1), руководства по
эхокардиографии (2), руководства по чрезкожной коронаропластике (4).
2. ОБЩИЕ ПРИНЦИПЫ
2.1. Оценка пациента с сердечным
шумом
2.1.1. Введение
Аускультация сердца остается наиболее широко используемым методом
диагностики
Клапанных пороков сердца. Шумы
сердца возникают вследствие 3 главных факторов:
•
высокая скорость
кровотока через нормальные или измененные отверстия
•
поток крови через
суженное или деформированное отверстие в расширенную камеру сердца
•
регургитация крови (возвратный поток) через некомпетентный клапан.
Часто, более чем 1 из
этих факторов имеет место (5–7).
Шум в сердце может не иметь никакого
патологического значения или может быть важным ключом к диагностике
приобретенных, врожденных, или других структурных отклонений сердца (8).
Большинство
систолических сердечных шумов не связано
с заболеванием сердца.
Довольно часто шумы
связаны с физиологическим увеличением скорости кровотока (9). В тоже время, шум в
сердце может являться ключом к диагнозу скрытой сердечной болезни
(например, клапанный
стеноз устья аорты [КСУА]). В этом случае показаны различные неинвазивные
или инвазивные
исследования сердца для установления диагноза и организации наблюдения и
лечения. Эхокардиография особенно
полезна в этом отношении, как обсуждено в “ACC/AHA/ASE
2003 ” (2). – название
по англ
Диастолические шумы почти всегда
являются патологическими и требуют дальнейшей диагностической оценки, также как
и шумы, не связанные непосредственно с фазой сердечного цикла. К последним, в
частности, относятся
"невинные" венозные и
дыхательные шумы.
Традиционный метод
оценки сердечного шума при аускультации основан на следующих характеристиках
шума: временная связь с фазами сердечного цикла, конфигурация, точка
выслушивания и иррадиация, высота (частота), интенсивность (степень от 1 до
6) и продолжительность (5–9). Конфигурация шума
может быть: crescendo, decrescendo, crescendo-decrescendo (ромбовидный), плато. Время начала и прекращения патологического
сердечного шума зависит от градиента давления между сообщающимися камерами
сердца
(5–9).
Классификация
сердечных шумов
приведена в
Таблице 1.
Таблица 1. Классификация сердечных шумов
1.
Систолические
шумы
a. Голосистолические
(пансистолические)
шумы
b. Среднесистолические
(систолическое
изгнание) шумы
c. Ранние систолические шумы
d. Средне-поздние систолические шумы
2.
Диастолические
шумы
a. Ранние высокочастотные диастолические
шумы
b. Среднедиастолические шумы
c. Пресистолические шумы
3.
Непрерывные
(систолодиастолические) шумы
2.1.2. Классификация
шумов
Голосистолические (пансистолические) шумы
появляются когда градиент давления между камерами сердца сохраняется высоким на
протяжении всей систолы. При патологической регургитации обратный кровоток по
градиенту давления начинается рано, когда
расслабление еще не полное. Среднесистолические (систолическое изгнание)
шумы, часто типа crescendo-decrescendo
возникают при изгнании крови через аортальный или легочной пути оттока. Эти шумы начинаются
вскоре после I тона, когда давление в
желудочке повышается достаточно для открытия полулунного клапана.
При увеличении скорости кровотока шум изгнания увеличивается, при
снижении - уменьшается.
При неизмененных полулунных клапанах
среднесистолический шум может быть связан с увеличенным сердечным выбросом
(беременность, тиреотоксикоз, анемия, артериовенозный шунт), потоком крови в
расширенный сосуд вне клапана, усилением звука вследствие тонкой стенки грудной
клетки. Чаще всего «невинные» шумы у детей и подростков являются
среднесистолическими и происходят из аортального или из легочного путей оттока.
Клапанный, надклапанный или подклапанный стеноз (аорты или легочной артерии)
может также проявляться среднесистолическим шумом, интенсивность которого
зависит от скорости кровотока через сужение.
Среднесистолические шумы также бывают у некоторых пациентов с
функциональной митральной недостаточностью (МН) или, реже, с трикуспидальной
недостаточностью (ТН).
Часто только эхокардиография
позволяет дифференцировать четкий и усиленный (степень 3)
доброкачественный
среднесистолический шум от шума обусловленного КСУА.
Ранние систолические шумы встречаются реже, чем среднесистолические; они
начинаются
с первым тоном и заканчиваются в
середине систолы. Ранний систолический шум возникает часто
вследствие ТН при отсутствии
легочной гипертензии, и, в тоже время, он может иметь место у пациентов с
острой МН. При больших дефектах межжелудочковой перегородки с легочной
гипертензией и маленьких мышечных
дефектах межжелудочковой перегородки шунтирование в конце систолы может быть
незначащим с шумом, ограниченным ранней и средней систолой.
Выслушиваемые в области верхушки левого желудочка (ЛЖ) поздние
систолические шумы - мягкие
(неинтенсивные) или умеренно громкие, высокочастотные;
начинаются значительно позже изгнания и заканчиваются раньше II тона или сливаются с II тоном. Они связаны с неполным
смыканием митральных створок, которые обусловлены анатомическими и
функциональными изменениями фиброзного кольца и ЛЖ. Поздние систолические шумы
у пациентов со среднесистолическим щелчком (кликом) являются результатом
поздней регургитации
из-за пролабирования митральной
створки (митральных створок) в левое предсердие. Такие шумы могут также
выслушиваться без кликов.
Ранние диастолические шумы начинаются вскоре после II тона, когда давление в левом
желудочке становится ниже, чем давление в аорте или в легочной артерии.
Высокочастотные шумы аортальной регургитации (АР) или пульмональной
регургитации вследствие легочной гипертензии чаще убывающие (decrescendo) связаны с быстрым снижением объема
или степени регургитации в течение диастолы. Диастолический шум пульмональной
регургитации без легочной гипертензии является низко-среднечастотным, и начало
этого шума несколько отсрочено, потому что регургитационный поток минимальный
при закрытии клапана легочной артерии,
когда обратный градиент давления вызывающий регургитацию минимальный.
Такие шумы появляются обычно в поздний период после реконструкции тетрады
Фалло.
Среднедиастолические шумы обычно возникают на митральном или
трикуспидальном клапане в период раннего диастолического наполнения; их
причиной является относительное несоответствие между площадью
атриовентрикулярного отверстия и диастолическим объемом кровотока.
Среднедиастолические шумы
свойственны для митрального и трикуспидального стенозов. Но
они могут также возникать вследствие
увеличения диастолического кровотока:
·
через
митральный или трикуспидальный клапаны при чистой регургитации на этих клапанах
·
через
нормальный митральный клапан (МК) при дефекте межжелудочковой перегородки или
открытом артериальном протоке
·
через
нормальный трикуспидальный клапан у пациентов с дефектом межпредсердной
перегородки.
При тяжелой хронической
АР низкочастотный грохочущий диастолический шум (шум Остина-Флинта) часто
выслушивается на верхушке, он может быть или среднедиастолический или
пресистолический.
Щелчок открытия отсутствует при изолированной АР.
Пресистолические шумы начинаются в течение
периода желудочкового наполнения обусловленного сокращением предсердия и,
поэтому их возникновение связано с синусовым ритмом.
Они бываю обычно при
стенозе атриовентрикулярного отверстия.
Миксома в правом или в
левом предсердии может также сопровождаться среднедиастолическим или
пресистолическим шумом подобным шуму при трикуспидальном или митральном стенозе
(МС).
Непрерывные шумы появляются при шунте от
высокого к низкому давлению и занимают конец систолы и начало диастолы. То
есть, они начинаются в систоле, достигают пика рядом со II
тоном и
продолжаются всю
диастолу или часть диастолы. Существуют многие причины для непрерывных шумов,
но они несвойственны пациентам с клапанными пороками сердца (5–9).
2.1.2.1. Динамическая
аускультация сердца
Внимательная
аускультация сердца в течение изменений сердечной гемодинамики
часто позволяет
исследователю найти правильное происхождение сердечного шума и выяснить его
значение
(10–13). Изменения в
интенсивности шумов в сердце в течение
различных проб приведены
в Таблице
2.
Таблица 2. Пробы, используемые для изменения интенсивности сердечных шумов
Дыхание
Шумы из правых отделов сердца часто
увеличиваются на вдохе. Шумы из левых отделов сердца обычно громче на выдохе.
Проба Вальсальвы
Большинство шумов уменьшаются по
продолжительности и интенсивности. Как исключение - систолический шум при ГКМ,
который обычно становится намного громче, и шум ПМК, который становится более
продолжительным и часто более громким. После пробы шумы из правых отделов
сердца имеют тенденцию возвращаться к
первоначальной интенсивности раньше чем
шумы из левых отделов сердца.
Физическая нагрузка
Шумы, вызванные кровотоком через нормальные или суженные
клапаны (например, СУЛА и МС) становятся громче от изотонической и изометрической нагрузки (кистевая
динамометрия). Шумы МР, ДМЖП и АР также увеличиваются при изометрической
нагрузке.
Позиционные изменения
При вставании, большинство шумов
уменьшается. Два исключения: шум при ГКМ, который становится громче, и шум при
ПМК, который часто усиливается и продолжительность его увеличивается. При
сидении на корточках, большинство шумов становится громче, но шумы при ГКМ и
ПМК обычно уменьшаются и могут исчезнуть. Подъем ног в положении лежа обычно
дает те же самые результаты как сидение на корточках.
Экстрасистолия или фибрилляция
предсердий
Шумы, связанные с нормальными или со
стенозированными полулунными клапанами,
увеличиваются в течение сердечного цикла после ЖЭ или после длинного
интервала при ФП. В отличие от этого,
систолические шумы из-за регургитации на атриовентрикулярном клапане не
изменяются, уменьшаются (папиллярная дисфункция), или становятся короче (ПМК).
Фармакологические вмешательства
В течение начальной относительной
гипотонии после ингаляции амилнитрита интенсивность шума при МР, ДМЖП и АР уменьшаются, тогда, как шумы при
АС становятся громче из-за увеличенного выброса. В течение более поздней фазы
тахикардии также увеличиваются шумы при
МС и патологические шумы из правых отделов сердца. Это вмешательство помогает
таким образом отличить шум Остина-Флинта от шума при MS. Реакция на пробу при
ПМК часто является двухфазной (сначала уменьшение интенсивности шума затем
увеличение).
Временная артериальная окклюзия
Временное внешнее пережатие обеих рук
двусторонней воздушной манжеткой на 20 мм больше чем систолическое артериальное
давление увеличивает шумы МР, ДМЖП и АР, но не шумы из-за других причин.
ФП
обозначает фибрилляцию предсердий; АР, аортальная регургитация; АС,
аортальный стеноз; ГКМ, гипертрофическая кардиомиопатия; МР, митральная
регургитация; МС, митральный стеноз; ПМК, пролапс митрального клапана; СУЛА,
стеноз устья легочной артерии; ЖЭ, желудочковая экстрасистола; ДМЖП, дефект
межжелудочковой перегородки.
2.1.2.2. Дополнительные
физические исследования
Данные, полученные с помощью
дополнительных исследований, помогают оценить сердечный шум и необходимость в
дальнейшем обследовании (рис. 2). Например, шум из правых отделов сердца, занимающий раннюю и
среднюю части диастолы, выслушивающийся
по левой парастернальной линии у мечевидного отростка, вероятно, связан с ТР
без легочной гипертензии у получающего инъекции пациента с лихорадкой,
петехиями, узлами Ослера и красными пятнами на ладонях и подошвах (повреждения Janeway).
Правильная интерпретация других помимо
шума сердечных феноменов часто позволяет установить правильный диагноз.
Фиксированное расщепление II тона на протяжении
вдоха и выдоха у пациента со среднесистолическим шумом (степень 2-6),
выслушиваемое над легочной артерией и вдоль левой парастернальной линии,
позволяет предположить дефект межпредсердной перегородки.
Слабый или отсутствующий
II тон над аортой или парадоксальное расщепление II
тона могут указывать на тяжелый АС.
Выслушиваемый над аортой ранний систолический тон изгнания во время
вдоха и выдоха предполагает двустворчатый аортальный клапан, тогда как тон
изгнания, выслушиваемый только над
легочной артерией и вдоль левой парастернальной линии на вдохе
обычно указывает на
стеноз устья легочной артерии. Дилатация ЛЖ, определяемая при пальпации
прекардиальной области и двусторонние
легочные хрипы подтверждают диагноз тяжелой хронической МР у пациента с
голосистолическим шумом степени 2-6, выслушиваемом на верхушке сердца.
Медленный и малый артериальный пульс предполагает выраженный СУА со
среднесистолическим шумом степени 2-6, выслушиваемым во втором межреберье
справа от грудины.
Типичный пульс parvus et tardus
может отсутствовать у пожилых, даже с выраженным СУА, вследствие воздействия
возраста на сосуды. Pulsus parvus
может также иметь место при уменьшении сердечного выброса от любой причины.
Факторы, которые помогают в дифференциальном диагнозе обструкции тракта оттока
ЛЖ, перечислены в Таблице 3 (14). Оценка формы волны яремных вен может дать дополнительную
или подтверждающую информацию. Например, регургитационные cv
волны указывают на ТР и часто имеют место без четко
различаемого шума.
Таблица 3. Дифференциальная
диагностика различных причин обструкции выходного тракта левого желудочка
Фактор Клапанный Надклапанный Подклапанный Обструктивная ГКМ
непостоянный
Кальцификация клапана Обычно после 40 лет Нет Нет Нет
Расширение восходящей аорты Обычно после 40 лет Редко Редко Редко
ПД после ЖЭ Увеличивается Увеличивается Увеличивается Уменьшается
СШ при пробе Вальсальвы Уменьшается Уменьшается Уменьшается Увеличивается
Шум АР Обычно после 40 лет Редко
Иногда Нет
Четвертый сердечный тон (S4) Если тяжелый Несвойствен Несвойствен Обычен
Парадоксальное расщепление Иногда * Нет Нет Скорее обычен*
Щелчок изгнания Большинство (если
клапан Нет Нет Несвойствен или
не кальцифицирован),
не бывает
Максимальное дрожание и шум 2-е МРП 1-е МРП 2-е МРП 4-е МРЛ
Каротидный пульс От нормального
к Неправильный От нормального Высокий, скорый,
анакротическому*
анакротическому систолический
отскок
(parvus
и
tardus)
*Зависит от тяжести. Изменено с
разрешения Marriott HJL. Bedside cardiac
diagnosis. Philadelphia, PA: Lippincott; 1993:116.
АР обозначает аортальную
регургитацию; ГКМ, гипертрофическая кардиомиопатия; МРП, правое межреберье;
МРЛ, левое межреберье; ПД, пульсовое давление; СШ, систолический шум; ЖЭ,
желудочковая экстроасистола.
2.1.2.3. Дополнительные
симптомы
Диагностически важным у
пациента с сердечным шумом является
наличие или отсутствие других симптомов (15) (рис. 2). Например, обморок, стенокардия или сердечная
недостаточность у пациента со
среднесистолическим шумом приводят обычно к более строгому диагностическому подходу, чем у
пациента с подобным шумом без этих симптомов.
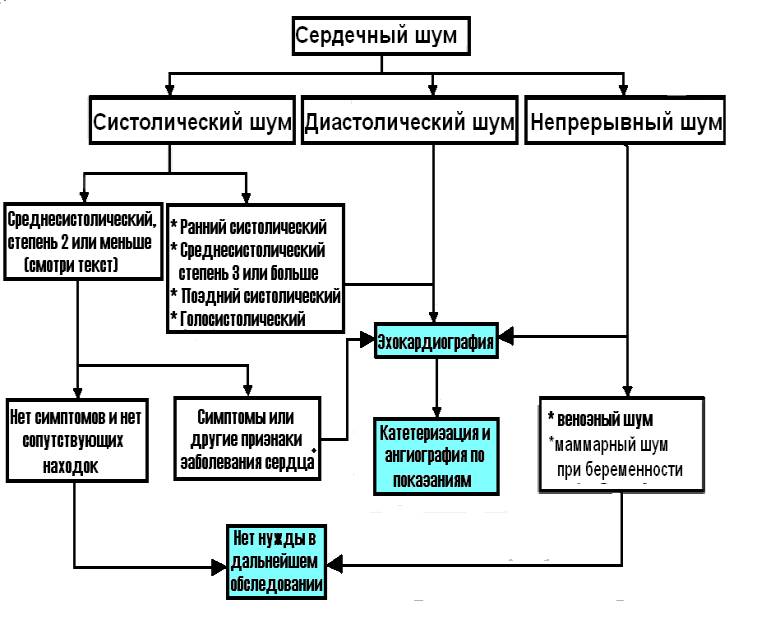 Рис 2.
Алгоритм оценки сердечных шумов.
*Эхокардиография показана, если есть патологические изменения на рентгенограмме органов грудной клетки или
на ЭКГ.
Рис 2.
Алгоритм оценки сердечных шумов.
*Эхокардиография показана, если есть патологические изменения на рентгенограмме органов грудной клетки или
на ЭКГ.
Для того, что бы
подтвердить или исключить значительный СУА показана эхокардиография.
Тромбоэмболия в анамнезе
требует более тщательного обследования. Эхокардиография показана пациентам с
сердечными шумами и клиническими данными, позволяющими предположить эндокардит (2).
Наоборот, много бессимптомных детей и
подростков со среднесистолическим шумом степени 2-6, но без других признаков
сердечных заболеваний не нуждаются в дообследовании после
сбора анамнеза и осмотра (рис. 2). Требует внимания
большая группа бессимптомных пожилых
пациентов, многие с системной гипертензией, у которых выслушивается
среднесистолический
шум обычно степени 1-2,
связанный со склерозированными створками аортального клапана, кровотоком в
изогнутых уплотненных магистральных сосудах или комбинацией этих причин. Эти
шумы надо отличать от таких же, вызванных более существенными утолщением и
кальцификацией клапана и снижением экскурсии створок в результате умеренной или
высокой степени КСУА. Отсутствие гипертрофии ЛЖ на электрокардиограмме (ЭКГ)
может быть достаточно убедительно, но часто требуется эхокардиография. Склероз аорты может проявляться
локализованными участками повышенной эхогенности, утолщением створок без
ограничения их подвижности и максимальной скоростью кровотока меньше, чем 2.0
метра в секунду. Выявление склероза
аортального клапана
может привести к более
активной профилактике коронарной болезни сердца. У пациентов с СУА трудно
оценить серьезность болезни, базируясь только на аускультации сердца.
2.1.3.
Электрокардиография и рентгенография грудной клетки
Хотя эхокардиография обычно обеспечивает
достаточно верную, а часто и количественную информацию о значении сердечного
шума и может быть единственным необходимым исследованием, ЭКГ и рентгенография
грудной клетки всегда доступны могут быть сделаны раньше других методов.
Отсутствие гипертрофии желудочков, дилатации предсердий, аритмий, нарушений
проводимости,
перенесенного инфаркта
миокарда и признаков острой ишемии на ЭКГ несет относительно дешевую и полезную отрицательную информацию.
Патологические изменения на ЭКГ у пациента с сердечным шумом, такие как
желудочковая гипертрофия или перенесенный инфаркт, должны вести к более
тщательному обследованию, включая эхокардиографию (рис. 2).
Обзорная
и боковая рентгенография грудной клетки часто дает качественную
информацию о размерах полостей сердца, легочном кровотоке, легочном и системном
венозном давлении и
и кальцификации сердца у
пациентов с сердечными шумами. Патологические изменения рентгенограммы органов
грудной клетки являются показанием к проведению эхокардиографии (рис. 2). Нормальная рентгенограмма грудной клетки и
ЭКГ обычно бывают у бессимптомных пациентов с изолированными
среднесистолическими шумами, особенно в младших возрастных группах, когда шум
по интенсивности степени 2 или меньше и выслушивается по левой парастернальной
линии
(16–18).
Обычная ЭКГ и
рентгенография органов грудной клетки не рекомендуются у этих пациентов.
2.1.4. Эхокардиография
Класс I
1. Эхокардиография
рекомендуется бессимптомным пациентам с диастолическими шумами, непрерывными
шумами, голосистолическими шумами, поздними систолическими шумами,
шумами, сопровождающимися щелчками изгнания, или
шумами, иррадиирующими в шею или спину.
(Уровень доказанности: C)
2. Эхокардиография
рекомендуется пациентам с сердечными шумами и признаками сердечной
недостаточности, ишемии
миокарда или инфаркта, обморока, тромбоэмболии, инфекционного эндокардита или другого клинически выявленного
органического заболевания сердца. (Уровень доказанности: C)
3. Эхокардиография
рекомендуется бессимптомным пациентам с систолическим шумом с максимумом в
середине систолы и со степенью 3 или больше. (Уровень доказанности: C)
Класс IIa
1. Эхокардиография может
быть полезной для оценки бессимптомных пациентов с шумами, которые
сопровождаются объективными симптомами или с шумами, сопровождающимися
патологической ЭКГ или измененной
рентгенограммой органов грудной клетки. (Уровень доказанности: C)
2. Эхокардиография может
быть полезной для пациентов с симптомами сердечного заболевания и/или
признаками вероятно несердечного происхождения, но у кого сердечное заболевание
не может быть исключено. (Уровень доказанности: C)
Класс III
Эхокардиография не
рекомендуется пациентам со среднесистолическим шумом степени 2 и ниже,
оцениваемым как невинный или функциональный опытным исследователем. (Уровень
доказанности: C)
Цветная и спектральная допплеровская
эхокардиография - важный неинвазивный метод для оценки
значения сердечных
шумов. Этот метод позволяет получить информацию о строении и функции клапана,
размере полости, толщине стенки, функции желудочка, кровотоке в легочной и
печеночной венах и давлении в легочной артерии.
Хотя эхокардиография может нести важную
информацию, такое обследование не показано для всех пациентов с сердечными
шумами, в частности мало помогает в оценке бессимптомных молодых пациентов с коротким среднесистолическим
шумом степени 1 – 2 при нормальных физикальных данных. С другой стороны, для
некоторых пациентов с сердечным шумом трансторакальной эхокардиографии
недостаточно для постановки диагноза. В
зависимости от клиники, чрезпищеводная эхокардиография, магнитно-резонансная
томография сердца или зондирование сердца могут быть показаны для уточнения
характеристики клапанного повреждения.
Важно отметить, что допплеровские
ультразвуковые приборы очень чувствительные и могут обнаружить незначительную
или умеренную клапанную регургитацию на неизмененных трикуспидальном и легочном
клапанах у большого процента молодых здоровых субъектов и на нормальных
левосторонних клапанах (особенно МК) в непостоянном, но более низком проценте
пациентов (16,19–22).
Разработаны общие рекомендации по
проведению эхокардиографии у пациентов с сердечными шумами. Конечно, возможны
индивидуальные исключения из этих рекомендаций.
2.1.5. Зондирование
сердца
Зондирование сердца может дать важную
информацию о наличии и серьезности клапанной обструкции, клапанной регургитации
и внутрисердечного шунтирования. Оно не является обязательным у большинства
пациентов с сердечными шумами и нормальной эхокардиограммой, но дает
дополнительную информацию у ряда пациентов при несоответствии между
эхокардиографией и клиническими данными.
Показания для
зондирования сердца с целью гемодинамической оценки различной клапанной
патологии приведены в разделе 3 “Отдельные клапанные повреждения Клапана” этого
руководства.
Отдельные показания для
коронарной ангиографии при ИБС даны в разделе 10.2.
2.1.6. Нагрузочные тесты
Нагрузочные тесты могут
быть вполне информативны у пациентов с клапанным пороком сердца, особенно у
тех, симптомы которых трудно оценить. Нагрузочные тесты можно объединять с
эхокардиографией,
радионуклидной ангиографией и зондированием сердца. Имеются данные о безопасности
этой процедуры даже среди бессимптомных пациентов с тяжелым АС. Нагрузочные
тесты пока недостаточно использовались в этом группе пациентов и должны со
временем стать важным компонентом их обследования.
2.1.7. Подход к пациенту
Диагноз пациента с сердечным шумом может
значительно изменится в результате подходов, обсужденных выше (23,24). Речь идет о
принадлежности шума к определенной фазе сердечного цикла, области выслушивания
шума и его иррадиации, его ответе на различные физиологические пробы (Таблица 2). Также важным является
присутствие или отсутствие сердечных и несердечных симптомов, что делает шум
клинически значимым. Это относится и к данным, полученным при нагрузочных
тестах (рис.
2).
Кандидатами на эхокардиографию являются пациенты
с диастолическими или непрерывными шумами в сердце, кроме шейного венозного
шума или маммарного дыхательного шума у беременных. Если эхокардиография
выявляет заболевание сердца, показано дальнейшее клиническое обследование.
Эхокардиография также рекомендуется пациентам с голосистолическим или поздним
систолическим шумом, выслушиваемом на верхушке или у левого края грудины,
пациентам со среднесистолическим шумом степени 3 или более интенсивными и
пациентам с более мягкими систолическими шумами, у которых аускультация в
динамике предполагает определенный диагноз (например, гипертрофическая
кардиомиопатия).
Эхокардиография рекомендуется пациентам,
у которых интенсивность систолического шума увеличивается при пробе Вальсальвы, шум становится громче, когда пациент
принимает вертикальное положение, и уменьшается в интенсивности, когда пациент
садится на корточки. Эти ответы предполагают диагноз гипертрофической
обструктивной кардиомиопатии или пролапса МК (ПМК). В то же время, дальнейшее обследование показано, когда
систолический шум становится громче при преходящей артериальной окклюзии, при
длительное кистевой динамометрии или не
увеличивается по интенсивности в сокращении, которое следует за желудочковой экстрасистолой
или после длительного интервала R-R у
пациентов с фибрилляцией предсердий. При этих обстоятельствах вероятен диагноз
МР дефекта межжелудочковой перегородки.
У многих пациентов со
среднесистолическим шумом степени 1 или
2 масштабное обследование не
обязательно. Это – особенно верно для бессимптомных детей и подростков, которые
имеют хотя бы одно нормальное сердечное исследование, и у которых нет других
физикальных признаков сердечного заболевания. Однако, эхокардиография показана
отдельным пациентам со среднесистолическим
шумом степени 1 или 2, включая пациентов с симптомами инфекционного эндокардита, тромбоэмболии, сердечной
недостаточности, ишемии или инфаркта миокарда, обморока. Эхокардиография обычно
позволяет уточнить диагноз у пациентов с другими патологическими физикальными
данными, включая широкое расщепление II тона, систолические
щелчки изгнания и определенные изменения интенсивности систолического шума при
исполнении физиологических проб (Табл. 2).
Эхокардиография показана пациентам с
клинически важным сердечным шумом. Но необходимо повторно подчеркнуть, что
незначительная, минимальная или
физиологическая клапанная регургитация
выявленная с помощью метода цветного отображения кровотока у многих здоровых
пациентов, особенно связанная с
митральным, трикуспидальным или легочным клапанами, часто не сопровождается ни
каким сердечным шумом. (16,19–22). Это надо учитывать,
когда эхокардиография проводится у бессимптомных пациентов с изолированным
шумом для уточнения диагноза.
Немногочисленные источники обращаются к
рентабельности различных подходов к оценке сердечного шума. Правильная
аускультация хорошо обученными исследователями может помочь достоверно
распознать незначащий среднесистолический шум (показана аускультация сердца в
динамике) и приводит к менее частому использованию дорогих дополнительных
исследований нужных для исключения
шумов, не указывающих на сердечную патологию.
Ниже указаны особенности невинных шумов у
бессимптомных взрослых пациентов, которые не имеют никакого функционального
значения:
• интенсивность степени 1 - 2 по левой
парастернальной линии
• вид систолического изгнания
• нормальная интенсивность и раздвоение II
тона
• нет других патологических тонов или шумов
• нет признаков гипертрофии или дилатации
желудочков и отсутствие увеличения интенсивности
шума при пробе Вальсальвы или в положении сидения на корточках (12).
Такие шумы особенно часто бывают при
повышении сердечного выброса, например, при анемии или беременности (25,26). Точный диагноз
возможен только тогда, когда
характерные особенности отдельных шумов сопоставляются с данными
анамнеза и осмотра (24). У пациентов с
неоднозначными клиническими данными эхокардиография может часто помочь
установить диагноз, делая рентгенографию органов грудной клетки и/или ЭКГ
ненужными.
Цели использования
эхокардиографии при оценке сердечных шумов:
• определить первичное повреждение в отношении
причины и тяжести
• определить гемодинамику
• определить сопутствующую патологию
• обнаружить вторичные повреждения
• оценить размеры и функцию полостей сердца
• установить контрольную точку для будущих
сравнений
• переоценить пациента после вмешательства.
Согласно этим
рекомендациям лечебные вмешательства будут часто зависеть от определенных
эхокардиографических измерений ЛЖ и систолической функции. Точность и
воспроизводимость исследования являются решающими, особенно когда применяются
хирургические рекомендации для бессимптомных пациентов с МР
или АР. Последовательные измерения в течение долгого времени, или
переоценка с помощью различных визуализационных методов (радионуклидная
вентрикулография или магнитно-резонансная томография сердца), являются часто
полезными
для отдельных пациентов.
Наконец, хотя портативный эхокардиограф может использоваться для скрининга,
важно отметить, что его точность в высокой степени зависит от опыта
исследователя. Значение портативного
эхокардиографа для оценки пациентов с клапанным пороком сердца пока не
установлено.
Столь же ценным, как эхокардиография
может быть основной физикальный осмотр сердечно-сосудистой системы, который
пока еще остается самым соответствующим методом скрининга для сердечного
заболевания и постановки большинства клинических диагнозов. Эхокардиография не
должна заменить физикальный осмотр, но может быть полезной в определении
причины и тяжести клапанных повреждений, особенно у пожилых и/или симптомных
пациентов.
2.2. Таблица тяжести
клапанных пороков
Классификация тяжести клапанных пороков у
взрослых указана в таблице 4 (27). Классификация для клапанной регургитации адаптирована
из рекомендаций American Society
of Echocardiography (27). За полнотекстовыми рекомендациями American Society
of Echocardiography обратитесь к оригиналу документа. Последующие разделы текущего
руководства обращаются к критериям в таблице 4 (27)
Для определения тяжести
клапанного стеноза или регургитации.
Таблица 4. Классификация тяжести клапанных пороков у
взрослых
А. Левосторонние клапанные пороки
Аортальный
стеноз
Показатель Легкий Умеренный Тяжелый
Максимальная скорость (м/сек) Менее 3.0 3.0–4.0
Более 4.0
Средний градиент (мм Hg)*
Менее 25 25–40 Более 40
Площадь
отверстия (см2) Более
1.5 1.0–1.5
Менее 1.0
Индекс
площади отверстия (см2/м2)
Менее 0.6
Митральный
стеноз
Легкий
Умеренный
Тяжелый
Средний
градиент (мм рт.ст.)* Менее 5 5–10 Более 10
Систолическое
давление в легочной артерии (мм рт.ст.) Менее 30 30–50 Более 50
Площадь
отверстия (см2) Более 1.5 1.0–1.5
Менее 1.0
Аортальная регургитация
Легкая
Умеренная
Тяжелая
Качественные
Ангиографическая степень 1+ 2+ 3–4+
Цветная
допплерография, соотношение скорости Центральная струя, Более чем при легкой но без
Центральная струя,
регургитации
и ширины выходного тракта ЛЖ (%) менее
25% признаков
тяжелой АР более 65%
Doppler vena contracta - ширина струи
регургитации
у
основания (см) Менее 0.3 0.3 –
0.6 Более
0.6
Количественные
(катетеризация или эхокардиография)
Объем
регургитации (мл на
сокращение сердца) Менее 30 30–59 Более или равно 60
Фракция
регургитации (%) Менее 30 30–49 Более или
равно 50
Площадь
основания струи регургитации (см2) Менее 0.10
0.10–0.29 Более или равно 0.30
Дополнительные основные
критерии
Размер
левого желудочка
Увеличен
Митральная
регургитация
Легкая Умеренная Тяжелая
Качественные
Ангиографическая
степень
1+
2+ 3–4+
Цветная
допплерография, площадь струи Маленькая, центральная Более
чем при легкой но Vena contracta с
шириной
струя (менее 4 см2 или без критериев тяжелой МР более 0.7 см с большой
менее 20% площади
ЛП) центральной струей МР
(площадь более 40%
площади ЛП) или с
пристеночной
струей
любой
площади
направленной
в ЛП
Doppler vena contracta – ширина струи
регургитации
у основания (см) Менее 0.3 0.3 – 0.69 Более или равно
0.70
Количественные
(катетеризация или эхокардиография)
Объем
регургитации (мл на
сокращение сердца) Менее 30 30–59 Более или равно 60
Фракция
регургитации (%) Менее 30 30–49 Более или равно 50
Площадь
основания струи регургитации (см2)
Менее 0.20 0.2–0.39
Более или равно 0.40
Дополнительные основные
критерии
Размер
левого предсердия Увеличен
Размер
левого желудочка
Увеличен
Б. Правосторонние клапанные пороки
Характеристика
Тяжелый
трикуспидальный стеноз: Площадь отверстия менее 1.0 см2
Тяжелая
трикуспидальная регургитация Vena contracta – ширина более
0.7 cm и обратный систолический кровоток в печеночных венах
Тяжелый
стеноз устья легочной артерии: Максимальная скорость более 4 м/с или максимальный градиент более 60 мм рт. ст.
Тяжелая
легочная регургитация: Цветная струя заполняет выходной тракт; плотная непрерывная допплеровская волна
с
крутым нисходящим наклоном
*Клапанный градиент зависит
от потока и
когда используется для оценки тяжести клапанного стеноза, должен быть рассчитан с учетом сердечного выброса или преобладающего потока через клапан.
Изменено
с разрешения из Zoghbi WA, Enriquez-Sarano M, Foster E, et al. Recommendations for
evaluation of the severity of native valvular regurgitation with
two-dimensional and Doppler
echocardiography. J Am Soc Echocardiogr 2003;16:777–802 (27).
АР
обозначает аортальную регургитацию;
ЛП, левое
предсердие; ЛЖ, левый желудочек; МР, митральная регургитация.
2.3. Инфекционный
эндокардит и профилактика ревматизма
Следующая информация
основана на рекомендациях, изданных АНА в 1997 г. (28). Эти рекомендации
находятся в настоящее
время под пересмотром и будут изменены. Рекомендации по профилактике и лечению
неклапанных инфекционных сердечных заболеваний были изданы недавно (29).
2.3.1. Профилактика
инфекционного эндокардита
Класс I
Профилактика
инфекционного эндокардита рекомендуется следующим пациентам:
• Пациенты с протезами сердечных клапанов и
пациенты с анамнезом инфекционного эндокардита. (Уровень доказанности: C)
• Пациенты, которые имеют цианотический
врожденный порок сердца (например, единственный желудочек, транспозиция
магистральных артерий, тетрада Фалло). (Уровень доказанности: C)
• Пациенты с хирургической коррекцией
системно-легочных шунтов или кондуитов (трубчатых протезов). (Уровень
доказанности: C)
• Пациенты с врожденными клапанными
пороками сердца, особенно с двустворчатым аортальным клапаном, и пациенты с приобретенной клапанной
патологией (например,
ревматические пороки).
(Уровень доказанности: C)
• Пациенты, которые подверглись
реконструкции клапана. (Уровень доказанности: C)
• Пациенты, которые имеют гипертрофическую
кардиомиопатию с латентной обструкцией
или обструкцией в покое. (Уровень доказанности: C)
• Пациенты с ПМК и аускультативными
свидетельствами клапанной регургитации и/или утолщенными створками на
эхокардиографии. * (Уровень доказанности: C)
Класс III
Профилактика
инфекционного эндокардита не рекомендуется следующим пациентам:
• Пациенты с изолированным дефектом
межпредсердной перегородки типа secundum.
(Уровень доказанности:
C)
• Пациенты через 6 или больше месяцев после
успешный хирургической или чрезкожной пластики
дефекта межпредсердной перегородки, дефекта межжелудочковой перегородки
или открытого артериального протока. (Уровень доказанности: C)
• Пациенты с ПМК без МР или утолщенных
створок на эхокардиографии * (Уровень доказанности: C)
• Пациенты с физиологическими,
функциональными или невинными сердечными шумами, включая пациентов со склерозом
аортального клапана, определяемого по очагам повышенной эхогенности и
утолщенным створкам без ограничения из подвижности, и максимальной скорости меньшей, чем 2.0 м/с. (Уровень
доказанности: C)
• Пациенты с эхокардиографическим свидетельством физиологической МР
при отсутствии шума и с неизмененными клапанами. (Уровень
доказанности: C)
• Пациенты с эхокардиографическим
свидетельством физиологической ТР и/или легочной регургитации при отсутствии
шума и с неизмененными клапанами. (Уровень доказанности: C)
*Пациенты с ПМК без
регургитации требуют дополнительного клинического обследования. Показания для
антибиотической профилактики при ПМК обсуждены в разделе 3.5.2. Пациенты, у
которых нет МР, но у которых эхокардиография показывает утолщение и/или
уплотнение клапанных створок, и особенно мужчины 45 лет или старше, могут иметь
повышенный риск инфекционного
эндокардита (30). Приблизительно одна треть пациентов с ПМК без
МР в покое могут иметь вызванную нагрузочным тестом МР (31). У некоторых пациентов
МР может проявиться в одном случае и не проявиться в другом. В последнем
случае, когда нет достоверных данных, необходимо дополнительное клиническое
обследование, учитывая вид инвазивной процедуры, анамнез эндокардита и наличие
утолщения и/или уплотнения клапанных створок.
Инфекционный эндокардит
- тяжелое заболевание, связанное с существенной заболеваемостью и смертностью.
Его предотвращение назначением антибиотиков перед процедурами, которые могут
вызвать бактериемию, заслуживает серьезного рассмотрения. Экспериментальные
исследования показали, что эндотелиальное повреждение ведет к прилипанию
тромбоцитов, отложению фибрина и формированию небактериального эндокардиального
тромботического повреждения. При бактериемии микроорганизмы могут оседать на
этих повреждениях и размножаться в пределах комплекса тромбоциты-фибрин,
приводя к инфекционным вегетациям (30,32). Клапанные и врожденные пороки,
особенно те, которые
сопровождаются патологическими высокоскоростными струйными потоками, могут
вести к повреждению эндотелиального слоя, агрегации тромбоцитов и отложению
фибрина, повышая, таким образом, риск
бактериальной колонии.
Некоторые проблемы рассмотрены в
рекомендациях по профилактике эндокардита (33).
Рациональная
антибактериальная профилактика основана на следующем:
• Клинический случай, документально подтверждающий эндокардит после бактериемии.
• Бактериемия микроорганизмами, про которых
известно, что они вызывают эндокардит, следует за различными процедурами, типа
стоматологических вмешательств, эндоскопии и цистоскопии.
• Можно проверить чувствительность микроорганизмов
к различным антибиотикам.
• Антибиотики предупреждают эндокардит, вызванный Streptococcus viridans, в эксперименте.
• Небольшие клинические исследования у людей показываютп пользу профилактики
эндокардита (34,35).
Ценность профилактики сомнительна по
следующим соображениям:
• Недостаток любых рандомизированных
контролируемых клинических исследований, подтверждающих результаты исследований
на животных.
• Клинические сообщения о неэффективности
антибиотиков в профилактике эндокардита (33,36) или исследования,
которые показывают, что по всей вероятности профилактика не эффективна (37).
• Доказательства, что стоматологические и другие
процедуры вызывают эндокардит, являются косвенными. Бактериемия (положительная
культура крови) варьирует от 8 % (катетеризация мочевого пузыря) до 94 %
(периодонтальная хирургия/удаление зуба) (38), в то же время частота эндокардита
низкая (10 - 60 случаев
на 1 миллион человек в год) (33). Исследования показывают, что стоматологическое лечение
одно само по себе не является фактором риска эндокардита (39,40).
• При определенных обстоятельствах, таких как
профилактика во всех случаях ПМК, риск смерти из-за пенициллина, как оценивают,
является большим, чем риск инфекционного эндокардита (41,42).
Ввиду этих проблем, еще до руководств AHA,
в рекомендациях отмечалось, что риск эндокардита у пациентов с имеющейся сердечной патологией может быть
классифицирован как относительно высокий, умеренный, или низкий, что зависит от
конкретного сердечного заболевания (28).
Различные стоматологические и
хирургические процедуры ассоциируются с разной степенью и частотой бактериемии. Частота бактериемии наивысшая при стоматологических
и оральных процедурах, промежуточная при мочеполовых процедурах и самая низкая при желудочно-кишечных процедурах (33). Рекомендации для профилактики
эндокардита при стоматологическом, хирургическом и других вмешательствах
перечислены в Таблицах с 5 по 8 (28). Анекдотические
сообщения об инфекционном эндокардите
осложнившим персинг или татуировки подчеркивают
изменчивую природу этой
болезни.
Процедура — и таким образом, дверь
входа—определяет тип микроорганизмов, вызвавших
бактериемию, и диктует
выбор антибиотика для профилактики. Поскольку стрептококки - постоянные жители
ротовой полости, выбор антибиотиков для
профилактики для стоматологических и оральных
процедур направлен
против этих организмов. При мочеполовых
процедурах и, в меньшей степени, при желудочно-кишечных вмешательствах
антибактериальная профилактика направлена, прежде всего, против энтерококка.
Таблица 5. Профилактика эндокардита при нестоматологических процедурах
А. Рекомендуется профилактика эндокардита
Дыхательный
тракт
● Тонзилэктомия/аденоидэктомия
● Хирургическое
извлечение слизистой оболочки
● Бронхоскопия жестким
бронхоскопом
Желудочно-кишечный
тракт (профилактика
для пациентов с высоким риском; оптимальная для умеренного риска)
● Склеротерапия варикозно
расширенных вен пищевода
● Расширение
стриктуры пищевода
● Эндоскопическая ретроградная холангиография с билиарной обструкцией
● Хирургия билиарного
тракта
● Хирургическое
извлечение слизистой оболочки кишечника
Мочеполовой
тракт
● Хирургия предстательной
железы
● Цистоскопия
● Расширение уретры
Б. Не рекомендуется профилактика эндокардита
Дыхательный
тракт
● Эндотрахеальная
интубация
● Бронхоскопия гибким
бронхоскопом с или без биопсии*
● Тимпаностомия с вставкой
трубы
Желудочно-кишечный
тракт
● Чрезпищеводная
эхокардиография*
● Эндоскопия с или без желудочно-кишечной биопсии*
Мочеполовой
тракт
● Трансвагинальная
гистероэктомия*
● Физиологические роды*
● Кесарево сечение
● В неинфицированных
тканях:
Катетеризация
мочевого пузыря
Расширение
матки и кюретаж
Терапевтический
аборт
Стерилизация
Вставка
или удаление внутриматочных устройств
Другое
● Катетеризация сердца, включая баллонную ангиопластику
● Имплантация
кардиостимуляторов, дефибрилляторов
и коронарных стентов
● Иссечение или биопсия в
хирургии кожи
● Обрезание
*Профилактика проводится пациентам с высоким риском. Перепечатано с разрешения из Dajani AS,
Taubert KA, Wilson W, et al.
Prevention of bacterial endocarditis:
recommendations by the American Heart Association. Circulation 1997;96:358–66 (28).
Таблица 6. Профилактика эндокардита при стоматологических процедурах
А. Профилактика эндокардита рекомендуется
Удаление
зуба
Пародонтальные
процедуры, включая
хирургию, покрытие и выравнивание корней,
зондирование и восстановление
Установка
зубных имплантантов и реимплантация вырванных зубов
Эндодонтальные (корневой канал) вмешательства или хирургия вне верхушки
Субгингивальная установка волокон/полос с антибиотиком
Первоначальное размещение ортодонтических
полос (но не скобок)
Внутрисвязочные местные анестезирующие
инъекции*
Профилактическая
чистка зубов или имплантантов, если кровотечение не исключено
Б. Профилактика эндокардита не рекомендуется
Укрепляющее лечение зубов† (операционное и простодонтальное) с/без ретракционного зонда
Местные
анестезирующие инъекции (не
внутрисвязочные)*
Внутриканальное
эндодонтальное лечение; после установки и наращивания
Пломбирование
Удаление
швов
Размещение
сменных простодонтальных/ортодонтальных
конструкций
Снятие
оттисков зубных рядов
Обработка
фтористыми соединениями
Снятие
рентгеновских снимков
Регулировка
ортодонтического аппарата
Удаление
молочных зубов
*Внутрисвязочные инъекции направлены
между корнями и костной тканью для ввода анестетика в надкостницу.
†Включает пломбирование
зубов и замену недостающих зубов. В
некоторых случаях, особенно с существенным кровотечением, показано назначение
антибиотиков.
Перепечатано с разрешения из Dajani AS, Taubert KA, Wilson W, et al. Prevention
of bacterial endocarditis: recommendations by
the American Heart Association. Circulation
1997;96:358–66 (28).
Таблица 7. Режимы профилактики эндокардита для стоматологических процедур,
процедур в ротовой полости, в дыхательных путях и в пищеводе
Ситуация Агент Режим*
Стандартная
общая профилактика Amoxicillin Взрослые: 2.0 г; дети: 50 мг на кг внутрь за 1 час до процедуры
Невозможно
принять препарат внутрь Ampicillin Взрослые 2.0 г в/м или в/в;
дети: 50 мг на кг в/м
или в/в за 30 мин до процедуры
При
аллергии к пенициллину Clindamycin или Взрослые: 600 мг; дети: 20 мг на кг внутрь
за 1 час до процедуры
Cephalexin или
Взрослые: 2.0 г; дети 50 мг на
кг внутрь за 1 час до процедуры
Cefadroxil† или Взрослые: 2.0 г; дети 50 мг на кг внутрь за 1 час до
процедуры
Azithromycin или
Взрослые: 500 мг; дети 15 мг на
кг внутрь за 1 час до процедуры
Clarithromycin Взрослые: 500 мг; дети 15 мг на кг внутрь за 1 час до процедуры
При
аллергии к пенициллину и
невозможности
принять препарат внутрь Clindamycin или
Взрослые: 600 мг; дети 20 мг на
кг в/в за 30 мин до процедуры
Cefazolin† Взрослые 1.0 г; дети 25 мг на кг
в/м или в/в за 30 мин до процедуры
*Полная детская
доза не должна превышать взрослую дозу.
†Цефалоспорины не должны использоваться у пациентов с
реакцией гиперчувствительности непосредственного типа (крапивница,
ангионевротический отек или анафилаксия) к пенициллину. Перепечатано с разрешения из Dajani AS, Taubert KA, Wilson W, et al. Prevention
of bacterial endocarditis: recommendations by the American Heart Association. Circulation 1997;96:358–66 (28).
В/м
обозначает внутримышечно; в/в, внутривенно.
Таблица 8. Режимы профилактики эндокардита для мочеполовых/желудочно-кишечных (кроме эзофагеальных) процедур
Ситуация Агент(ы)* Режим†
Пациенты
высокого риска Ampicillin + gentamicin Взрослые: ampicillin 2.0 г в/м,
в/в + gentamicin 1.5 мг на кг (но не
более
120 мг) за 30 мин до
начала процедуры. Шесть
часов спустя ampicillin 1 г
в/м, в/в или amoxicillin 1 г
внутрь.
Дети: ampicillin 50 мг на кг
в/м или в/в (но не
более 2.0 г) + gentamicin 1.5 мг
на кг за 30 мин до
начала процедуры. Шесть
часов спустя ampicillin 25 мг на
кг в/м, в/в или amoxicillin 25 мг на кг внутрь.
Пациенты
высокого риска с Vancomycin + Взрослые: vancomycin 1.0 г в/в в
течение 1–2 ч + gentamicin 1.5 мг на кг в/в,
аллергией
к ampicillin/amoxicillin gentamicin в/м (но не
более 120 мг). Завершить инъекцию/инфузию за 30 мин до
начала
процедуры.
Дети: vancomycin 20 мг на кг в/в в
течение 1–2 ч + gentamicin 1.5 мг на
кг
в/в, в/м. Завершить
инъекцию/инфузию за 30 мин до начала процедуры.
Пациенты
умеренного риска Amoxicillin или ampicillin Взрослые: amoxicillin 2.0 г внутрь
за 1 час до процедуры, или ampicillin 2.0 г
в/м, в/в за 30 до начала процедуры.
Дети: amoxicillin 50 мг на
кгвнутрь за 1 час до
процедуры, или ampicillin 50
Мг
на кг в/м , в/в за 30 мин до начала процедуры.
Пациенты
умеренного риска с Vancomycin Взрослые:
vancomycin 1.0 г в/в в течение 1–2 ч. Закончить инфузию
за 30 мин
аллергией
к ampicillin/amoxicillin
до начала процедуры.
Дети: vancomycin 20 мг на кг
в/в в течение 1–2 ч. Закончить инфузию за 30
мин до начала процедуры.
*Повторное введение vancomycin или gentamicin не рекомендуется. †Полная
детская доза не должна превышать взрослую дозу.Перепечатано с разрешения из Dajani AS, Taubert KA, Wilson W, et al. Prevention
of bacterial endocarditis: recommendations by the American Heart Association.
Circulation 1997;96:358–66 (28).
В/м
обозначает внутримышечно; в/в, внутривенно.
2.3.2. Профилактика ревматизма
2.3.2.1. Общие положения
Ревматизм - главная причина
клапанных пороков сердца. В Соединенных Штатах (и в западной Европе) случаи
острого ревматизм стали реже с 1970-ых годов. Но, начиная
в 1987 г., частота острого ревматизма стала возрастать (43,44). С развитием понимания бета-гемолитического стрептококка группы А,
как причины заболевания, выяснилось, что его ревматогенность
сопровождается распространением
серотипов М-белка микроорганизма. Это привело к развитию методик быстрого
обнаружения стрептококка группы А со специфичностью более чем 95%. Поскольку
тест имеет низкую чувствительность, отрицательный тест требует подтверждение
культуры горла (44). Первичная профилактика ревматизма включает быструю диагностику и лечение стрептококковой инфекции.
Для пациентов, которые
имели предыдущую атаку ревматизма, непрерывная антистрептококковая терапия
показана для вторичной профилактики.
2.3.2.2. Первичная
профилактика
Профилактика ревматизма
и руководящие принципы лечения представлены АНА (Таблица 9) (45).
Таблица 9. Первичная профилактика ревматизма
Агент
Доза Способ введения Продолжительность
Benzathine penicillin G Пациенты 27 кг или менее: 600 000 U Внутримышечно Одноразово
Пациенты более 27 кг: 1 200 000 U
или
Penicillin V (phenoxymethyl penicillin)
Дети: 250 мг 2–3 раза в
день
Внутрь 10 дней
Подростки и взрослые: 500 мг 2–3 раза в
день
Для
лиц с аллергией на penicillin
Erythromycin 20–40 мг на кг в день, в 2–4 приема Внутрь 10 дней
Estolate (максимально 1 г в день)
или
Ethylsuccinate 40 мг на кг в день, в 2–4 приема
Внутрь 10 дней
(максимально 1 г в день)
или
Azithromycin 500 мг в 1-й
день, 250 мг в день в
Внутрь 5 дней
следующие 4 дня
Перепечатано
с разрешения из Dajani A, Taubert K, Ferrieri P, et al. Treatment
of acute streptococcal pharyngitis and prevention of rheumatic fever: a
statement for health professionals. Committee on Rheumatic
Fever, Endocarditis, and Kawasaki Disease of the Council on Cardiovascular
Disease in the Young, the American Heart Association. Pediatrics 1995;96:758–64, Copyright © 1995 by the AAP
(45).
2.3.2.3. Вторичная профилактика
Класс I
Пациенты, которые имели ревматизм с
или без
кардита (включая пациентов с МС)
должны получать
профилактику обострения ревматизма.
(Уровень доказанности: B)
Пациенты, которые имели атаку
ревматизма имеют высокий риск перенести повторных обострений ревматизма.
Пациенты с ревмокардитом особенно склонны к повторным ревматическим атакам.
Вторичная профилактика повторных
ревматических атак имеет, таким образом, большое значение.
Непрерывная антибактериальная
профилактика доказала свою эффективность. Любой, кто перенес ревматизм с или без кардита (включая
пациентов с МС) должен получать профилактику обострения ревматизма. Руководящие
принципы АНА от 1995 г. по вторичной
профилактике представлены в таблице 10, руководящие принципы АНА от 1995 г. по продолжительности
вторичной профилактики представлены в
таблице 11 (45).
Таблица10. Вторичная профилактика ревматизма
Агент
Доза
Способ введения
Benzathine penicillin G 1 200 000 U каждые
4 недели (каждые
3 недели для пациентов высокого риска* Внутримышечно
(с
последствиями кардита)
или
Penicillin V 250 мг 2 раза в день Внутрь
или
Sulfadiazine 0.5 г один
раз в день пациентам с весом 27 кг или
меньше; 1.0 г один
раз в день Внутрь
пациентам с весом
более 27 кг
Для
лиц с аллергией к penicillin
и sulfadiazine
Erythromycin 250
мг 2 раза
в день Внутрь
*К пациентам высокого риска относятся
пациенты с последствиями ревматического кардита и пациенты из бедных
слоев. Перепечатано
с разрешения из Dajani A, Taubert K, Ferrieri P, et al. Treatment
of acute streptococcal pharyngitis and prevention of rheumatic fever: a
statement for health professionals. Committee on Rheumatic Fever, Endocarditis, and Kawasaki Disease of the Council on
Cardiovascular Disease in the Young, the American Heart Association. Pediatrics
1995;96:758–64, Copyright © 1995 by the AAP (45).
Таблица 11. Продолжительность вторичной профилактики ревматизма
Категория Продолжительность
Ревматизм
с кардитом и клапанным пороком сердца 10
лет и более после последней ревмоатаки, по крайней мере, до
возраста 40 лет; иногда пожизненная профилактика*
Ревматизм
с кардитом без клапанного порока сердца 10
лет или дольше, до достижения 21 года
Ревматизм
без кардита 5 лет
или дольше до достижения 21 года
*По пониманию комитета “пожизненная” профилактика относится к пациентам с высоким риском и частым
контактом с населением, в котором
распространена стрептококковая инфекция (учителя и воспитатели). Перепечатано с разрешения из Dajani A, Taubert K, Ferrieri P, et al. Treatment
of acute streptococcal pharyngitis
and
prevention of rheumatic fever: a statement for health professionals. Committee
on Rheumatic Fever, Endocarditis, and Kawasaki Disease of the Council on
Cardiovascular Disease in the Young, the American Heart
Association. Pediatrics 1995;96:758–64, Copyright © 1995 by the AAP (45).
3. ПОРОКИ СЕРДЦА
3.1. Стеноз устья аорты
3.1.1. Введение
Самая частая причина СУА
у взрослых – склероз створок клапана или врожденный двустворчатый клапан (46–49). Склероз
распространяется от основания створок, в конечном счете вызывая ограничение
движения створок и уменьшения площади отверстия аорты за счет сращения
комиссур. Склеротический СУА - активный патологический процесс,
характеризующийся отложением липидов, воспалением и кальцификацией, во многом подобен атеросклерозу (50–60). Ревматический СУА,
обусловленный сращением комиссур с разрушением и в итоге кальцификацией краев
створок встречается реже и всегда сопровождается поражением МК. Врожденный
порок клапан может также привести к стенозу и является более частой причиной в
молодом возрасте. Лечение врожденного СУА у подростков и молодых пациентов
обсуждены в Разделе 6.1.
3.1.1.1. Классификация
стеноза по степеням
Хотя СУА лучше всего
описан как непрерывная болезнь, и нет единого критерия для определения тяжести,
в этом руководстве мы классифицировали тяжесть СУА на основе особенностей
гемодинамики и данных осмотра (Таблица 4) (27,61), при этом используя определение максимальной
скорости потока крови в аорте, средний градиент давления и площадь отверстия:
• Легкий (площадь 1.5 см2, средний
градиент меньше чем 25 мм рт. ст., максимальная скорость меньше чем 3.0 м/с)
•
Умеренный (площадь 1.0 - 1.5
см2, средний градиент 25 – 40 мм рт. ст., максимальная
скорость 3.0 - 4.0 м/с)
•
Тяжелый (площадь меньше
чем 1.0 см2, средний градиент больше чем 40 мм рт. ст., максимальная
скорость больше чем 4.0 м/с).
Когда стеноз тяжелый и сердечный выброс нормальный, средний
трансклапанный градиент давления обычно больше чем 40 мм рт. ст. Однако, когда
сердечный выброс снижен, тяжелый стеноз может быть с более низким
трансклапанным градиентом и максимальной скоростью. Некоторые пациенты с
тяжелым СУА являются бессимптомными. Тогда как другие с только умеренным
стенозом имеют симптомы. Тактика
лечения, особенно связанная с корректирующей хирургией, базируется в
значительной степени на присутствии или отсутствии симптомов. Таким образом, абсолютная площадь аортального отверстия
или трансклапанный градиент давления сами по себе не определяют потребность в протезировании аортального
клапана (ПАК).
3.1.2. Патофизиология
У взрослых с СУА обструкция развивается
постепенно — обычно за десятилетия. За этот период левый желудочек приспосабливается к систолической перегрузке
давлением посредством гипертрофии,
которая приводит к увеличению толщины стенки ЛЖ, в то время как объем полости
ЛЖ остается нормальным (62–64). Относительное увеличение толщины стенки обычно достаточно для
того, чтобы противостоять высокому внутрикамерному систолическому давлению и, в
итоге, пристеночное напряжение (постнагрузка) остается в диапазоне нормальных
величин.
В силу обратного
соотношения между систолическим пристеночным напряжением и фракцией изгнания
фракция изгнания длительно сохраняется (65). Однако, если гипертрофия неадекватна и
толщина стенки не
увеличивается пропорционально давлению, пристеночное напряжение увеличивается и
высокая постнагрузка вызывает уменьшение фракции изгнания (65–67). Снижение фракции
изгнания может быть также вызвано уменьшением сократительной функции миокарда.
И часто трудно клинически определить, снижена ли фракция изгнания из-за
уменьшения сократимости миокарда или
из-за чрезмерной постнагрузки (68). Когда снижение фракции изгнания вызвано
уменьшением сократимости корректирующая хирургия будет менее эффективна, чем у
пациентов со снижением фракции изгнания, вызванным высокой постнагрузкой (69).
В результате увеличения толщины стенки,
снижения соотношения объем/масса и уменьшения
камерной податливости конечное диастолическое давление ЛЖ повышается без
дилатации камеры
(70–72). Таким образом, увеличенное конечное
диастолическое давление обычно отражает диастолическую дисфункцию, а не
систолическую дисфункцию или недостаточность (73). Усиленное
предсердное сокращение, которое вносит вклад в повышение конечного
диастолического давления, играет важную роль в желудочковом наполнении без
повышения среднего давления в левом
предсердии и в легочных венах (74). Исчезновение предсердного сокращения, как это бывает при
фибрилляции предсердий, часто сопровождается серьезным клиническим ухудшением.
Развитие концентрической гипертрофии
сопровождается соответствующей и полезной адаптацией, которая компенсирует
высокое внутриполостное давление. К сожалению, эта адаптация часто ведет к
неблагоприятным последствиям. В гипертрофированном сердце может быть ограничен
коронарный кровоток на грамм мышцы, также возникает ограничение коронарного
вазодилатационного резерва даже при отсутствии ИБС (75–77). Напряжение
гемодинамики при нагрузке или тахикардии может привести к перераспределению
коронарного кровотока и к субэндокардиальной ишемии, которая в свою очередь
может усугубить систолическую или диастолическую дисфункцию левого желудочка.
Гипертрофированное
сердце имеет повышенную чувствительность к ишемическому повреждению,
более тесно связано с
крупноочаговыми инфарктами и высокой смертностью, чем при отсутствии
гипертрофии
(78–80). С
другой стороны, что часто бывает у пожилых пациентов, особенно женщин, это
чрезмерная степень гипертрофии (толщина стенки больше той, которая необходима
для компенсации высокого внутриполостного давления) (81–84). В результате
систолическое пристеночное напряжение
низкое и фракция изгнания высокая; такая несоответствующая гипертрофия ЛЖ
связана с высокой периоперативной заболеваемостью и смертностью (81,83).
3.1.3. Анамнез
Анамнез СУА у взрослых включает
длительный латентный период, в течение которого заболеваемость и смертность
являются очень низкими. Скорость увеличения степени стеноза по- разному
оценивается в различных инвазивных и неинвазивных исследованиях (85). Даже при умеренном
стенозе (максимальная скорость кровотока больше чем 3.0 м/с) (Таблица 4) (27), средняя скорость
прогрессирования стеноза следующая - увеличение максимальной скорости
кровотока: 0.3 м/с ежегодно, увеличение
среднего градиента давления: 7 мм рт.
ст. ежегодно, уменьшение площади отверстия аортального клапана: 0.1 см2 ежегодно (86–96). Однако, имеются
индивидуальные колебания в скорости прогрессирования гемодинамических
изменений. Представляется, что прогрессирование СУА может быть более быстрым у
пациентов с дегенеративным атеросклерозом (кальцификацией), чем у пациентов с
врожденным СУА или ревматизмом(96–98). Но невозможно предсказать скорость
прогрессирования у каждого конкретного пациента. Поэтому постоянное клиническое
наблюдение обязательно для всех пациентов с легким и умеренным бессимптомным
СУА. Кроме того, прогрессирование с переходом в СУА может быть у пациентов с
аортальным склерозом, проявляющимся утолщением без обструкции пути оттока ЛЖ (99).
Аортальный склероз, определяемый как
неравномерное утолщение створок клапана без обструкции пути оттока ЛЖ, присутствует приблизительно
у 25 % взрослых старше 65 лет и ассоциирует с такими факторами риска как
возраст, пол, артериальная гипертензия, курение, уровень липопротеинов низкой
плотности и сахарный диабет (100). В исследовании Cardiovascular
Health Study
выявление
аортального склероза на эхокардиографии у лиц без диагностированной коронарной
болезни было также связано с неблагоприятным клиническим прогнозом: примерно на 50 % возрастал риск инфаркта
миокарда и сердечно-сосудистой смерти по сравнению с лицами с нормальным
аортальным клапаном (101). Это было подтвержденно в
2 дополнительных исследованиях (102 103). Эта связь между аортальным склерозом и неблагоприятным
сердечно-сосудистым прогнозом сохранялась даже с поправкой на возраст, пол,
выявленное сердечно-сосудистое заболевание и сердечно-сосудистые факторы риска.
Однако, механизм этой связи неясен и навряд ли она зависит от клапанной
гемодинамики. Исследования продолжаются в плане оценки возможных механизмов
этой связи, включая субклинический атеросклероз, эндотелиальную дисфункцию и
системное воспаление.
У большинстве пациентов с тяжелым СУА
нарушена агрегация тромбоцитов и уменьшен уровень фактора von Willebrand. Выраженность изменений коагуляции крови
коррелирует с тяжестью СУА. Эта корреляция исчезает после замены клапана, кроме
тех случаев, когда протезная площадь клапана является меньшей по сравнению с
должной по площади тела (меньше чем 0.8см2/м2).
Приобренный синдром von Willebrand ассоциирует с клиническим кровотечением, чаще всего петехии или
экхимозы, приблизительно у 20 % пациентов (104).
В конечном счете, признаки стенокардии,
обморока или сердечной недостаточности развиваются после длительного латентного периода, и последующие изменения
весьма драматичны. После появления признаков рассчитанное выживание
ограничивается 2 - 3 годами (105–111) с высоким риском внезапной смерти. Таким образом, появление указанных признаков знаменует
критическую
точку в анамнезе СУА.
Лечебные мероприятия в значительной степени основаны на этих данных;
большинство клиницистов лечат бессимптомных пациентов консервативно, тогда как
корректирующая хирургия вообще рекомендуется пациентам с симптомами,
предполагая, что эти симптомы принадлежат СУА. Важно подчеркнуть, что эти
симптомы могут быть неявными и часто не распознаются врачом при рутинном
клиническом осмотре.
Внезапная смерть, как известно, случается
у пациентов с тяжелым СУА и, как показано в старых ретроспективных
исследованиях, без предшествующих признаков (105 108 112 113). Однако,
в проспективных
эхокардиографических исследованиях, внезапная смерть у изначально бессимптомных
пациентов бывает редко (61,96,109,114–116). Поэтому, хотя внезапная смерть может быть при
отсутствие предшествующих симптомов у пациентов с СУА (105,108,112,113,116), это бывает редко менее
чем у 1% пациентов с диагностируемым СУА ежегодно
.
3.1.4. Лечение
бессимптомного пациента
Бессимптомные пациенты с
СУА имеют прогноз такой же, как у
соответствующих по возрасту здоровых взрослых лиц. Однако, начало болезни с
появлением симптома бывает часто, что детализировано в Таблице 12 (61,96,109,114–118). В проспективном исследовании 123-х бессимптомных
взрослых пациентов с максимальной скоростью кровотока не менее 2.6 м/с частота
появления симптома была 38 % за 3 года для всей группы. Однако, клинический
прогноз был
строго зависим от
тяжести СУА, показатель event-free survival
84 % за 2 года у пациентов с максимальной
скоростью кровотока меньше чем 3 м/с по сравнению с только 21 % у пациентов с
максимальной скоростью кровотока больше чем 4 м/с (61,98). В другом исследовании 128 бессимптомных взрослых с максимальной
скоростью кровотока не менее 4 м/с event-free survival
был 67
% за 1 год и 33% за 4 года с
предикторами прогноза: возраст и степень кальциноза клапана (96). В третьем исследовании у бессимптомных пациентов
(без хирургического вмешательства) с максимальной скоростью кровотока в аорте
больше чем 4 м/с получен подобный результат: 33 %
за 5 лет (116). Поэтому, пациенты с
бессимптомным СУА подлежат частому мониторингу для отслеживания течения
заболевания.
3.1.4.1.
Эхокардиография, показания при аортальном стенозе
Класс I
1. Эхокардиография
рекомендуется для диагностики и оценки тяжелого СУА. (Уровень доказанности:
B)
2. Эхокардиография
рекомендуется у пациентов с СУА для оценки толщины стенки, объема и функции ЛЖ.
(Уровень доказанности: B)
3. Эхокардиография
рекомендуется для переоценки у пациентов с диагностированным СУА и
непостоянными
симптомами. (Уровень доказанности: B)
4. Эхокардиография
рекомендуется для оценки изменений
гемодинамики и функции ЛЖ у пациентов с диагностированным СУА в период
беременности. (Уровень доказанности: B)
5. Трансторакальная
эхокардиография рекомендуется для переоценки бессимптомных пациентов: каждый
год для тяжелого СУА; каждые 1 - 2 года для умеренного СУА; каждые 3 - 5 лет
для легкого СУА. (Уровень доказанности: B)
Аортальный стеноз
обычно впервые подозревается на
основании обнаружение систолического шума изгнания при аускультации; однако,
данные осмотра являются определяющими (специфичными), но не чувствительными для
диагноза тяжелого СУА (119). К классическим признакам тяжелого СУА
относятся громкий (степень 4-6) поздний систолический шум,
распространяющийся на сонные артерии, раздвоение (в том числе парадоксальное)
второго тона, медленный и малый пульс на сонной артерии. Однако, у пожилых
каротидный пульс может быть нормальным из-за старения сосудов, и шум могут быть
мягким или может распространяться к верхушке. Что при осмотре является надежным
для исключения тяжелого СУА, это нормальное расщепление второго тона сердца (119).
Эхокардиография показана, когда есть
систолический шум степени 3/6 или
больше, нерасщепленный второй тон, или симптомы, которые могут указывать на
СУА. 2-мерная (2D)
эхокардиограмма представляет ценность для оценки анатомии и функции клапана и
определения реакции ЛЖ на перегрузку давлением. У почти всех пациентов тяжесть
стеноза может быть определена доплеровскими эхокардиографическими измерениями
максимальной скорости кровотока, среднего трансклапанного градиента давления и площади отверстия клапана, как обсуждено
в “ACC/AHA/ASE
2003 Guidelines for the
Clinical Application of Echocardiography” (2). Оценка тяжести СУА с помощью допплеровского исследования требует внимания к техническим
деталям, самой частой ошибкой быть недооценка тяжести заболевания из-за
непараллельности угла между лучом ультразвука и направлением потока крови
суженное отверстие клапана. Когда измерение диаметра пути оттока ЛЖ
проблематично, отношение скорости потока крови через тракт оттока ЛЖ к скорости
потока крови в аорте можно использовать для измерения площади отверстия
клапана; тем более, что это отношение уже не нуждается в индексации по площади
тела. Отношение от 0.9 до 1.0 - нормальное, отношение меньше 0.25 указывает на
тяжелый стеноз. Эхокардиография также используется для оценки размеров и
функции ЛЖ, степени гипертрофии наличия другого сочетанного клапанного порока.
У некоторых пациентов может быть
необходимо в самом начале провести зондирование сердца и коронарную
ангиографию. Например, это нужно сделать, если есть несоответствие между
клиническим и эхокардиографическим исследованиями или если есть симптомы ИБС.
3.1.4.2. Нагрузочные
тесты
Класс IIb
Нагрузочные тесты у
бессимптомных пациентов с СУА показаны для выявления индуцированных нагрузкой симптомов и неадекватной реакции
системного артериального давления. (Уровень доказанности: B)
Класс III
Нагрузочные тесты не
должно выполняться у симптомных пациентов с СУА. (Уровень доказанности: B)
Нагрузочное тестирование у взрослых с
СУА имеет низкую диагностическую точность для оценки сопутствующей ИБС.
По-видимому, это связано с наличием патологической исходной ЭКГ, гипертрофией
ЛЖ и ограниченным коронарным резервом. Электрокардиографическая депрессия ST в
течение нагрузки наблюдается у 80 % взрослых с бессимптомным СУА и не имеет
прогностического значение.
Нагрузочные тесты не должны выполняться
у симптомных пациентов вследствие высокого риска осложнений. Однако, у
бессимптомных пациентов, нагрузочное тестирование относительно безопасно и может
дать информацию, которая не была получена в течение предыдущего клинического
исследования (61,117,118,120–124). Когда анамнез неясен,
нагрузочный тест может определить толерантность к физической нагрузке,
неадекватный ответ артериального давления
или вызванные нагрузкой симптомы (117,118, 124). В одной серии исследований (117), пациенты, проявляющие
симптомы, неадекватный ответ артериального давления (увеличение меньше чем на
20 мм рт.ст.) или смещение ST-сегмента при нагрузке,
имели показатель event-free survival за 2 года только 19 %
по сравнению с 85 % event-free survival у тех, кто не имел этих изменений при
нагрузке. Четыре пациента умерли в течение этого исследование (ежегодная
смертность 1.2 %); все имели площадь аортального клапана меньше 0,7 см2 и патологический нагрузочный
тест. В другой серии (118), нагрузочное тестирование привело к симптомам у 29 % пациентов,
которые были бессимптомны до теста; у этих пациентов спонтанные симптомы
появились у 51 % в течение следующего года по сравнению с 11 % пациентов,
которые не имели никаких симптомов при нагрузочном тестировании. Неадекватный
гемодинамический ответ (например, гипотония или недостаточное повышение
артериального давления при нагрузке) у
пациента с тяжелым СУА считается слабым прогностическим признаком
(117,125). Наконец, у отдельных пациентов на основании
нагрузочного теста можно дать рекомендации по физической активности.
Нагрузочное тестирование у бессимптомных пациентов
должен быть выполнен
только под наблюдением опытныго врача с постоянным контролем артериального
давления и ЭКГ.
3.1.4.3. Динамическое
наблюдение
Частота последующих
контрольных визитов к врачу зависит от тяжести клапанного стеноза и наличия
осложнений. Признание того факта, что оптимальные показания для повторных обследований
не определены, многие врачи ежегодно осматривают пациентов с бессимптомным СУА
любой степени. Существенным компонентом каждого посещения является обучение
пациента, разъяснение особенностей течения болезни и симптоматики СУА. Показана
периодическая эхокардиография, как будет обсуждено ниже. Пациентам нужно
объяснить, что они должны сразу сообщать о любых изменениях в толерантности к физической нагрузке,
дискомфорте в грудной клетке в связи с
напряжением, одышке, слабости или обмороке.
Эхокардиография в динамике - важная часть
комплексного подхода, который включает детальный анамнез, осмотр, и, у
некоторых пациентов, тщательно мониторированный нагрузочный тест. Поскольку
темп прогрессирования болезни значительно варьирует, клиницисты часто назначают
ежегодную эхокардиографию пациентам с умеренным или тяжелым СУА.
Эхокардиография в динамике помогает оценить тяжесть стеноза, гипертрофию ЛЖ и
функцию ЛЖ. Поэтому, пациентам с тяжелым СУА эхокардиография показана ежегодно.
Пациентам с умеренным СУА
эхокардиографию в динамике достаточно выполнять каждые 1 - 2 года, а
пациентам с легким СУА – каждые 3 - 5 лет. Эхокардиография должны выполняться
чаще, если изменяются симптомы.
3.1.4.4. Медикаментозная
терапия
Профилактика
антибиотиками показана всем пациентам с СУА для предотвращения инфекционного
эндокардита и пациентам с ревматическим СУА для предотвращения обострения
ревматизма.
Пациенты с сопутствующей
системной артериальной гипертензией должны получать лечение
соответствующими
антигипертензивными препаратами. Учитывая эти исключения, нет специфической медикаментозной терапии
для пациентов, у которых еще не появились симптомы. Пациентам, у которых
появились симптомы, требуют хирургической коррекции, а не медикаментозной терапии.
Нет доказательств, что есть
медикаменты, способные предотвратить
или задержать патологический процесс в створках аортального клапана. Однако,
сочетание СУА с клиническими факторами, подобными факторам риска атеросклероза
и механизмами болезни на уровне ткани (50–60,99–103,126–129) ведет к гипотезе о
возможности замедлить или предотвратить прогрессирование болезни в створке
клапана (127,130).
В
нескольких небольших ретроспективных исследованиях с помощью эхокардиографии и
компьютерной томографии был исследован эффект липидснижающей терапии на
развитие склеротического СУА (131–136) с рекомендацией терапии статинами. Однако,
проспективное,
рандомизированное, плацебо-контролируемое
исследование пациентов со
склерозом аортального клапана не подтвердило сдерживающее действие
аторвастатина на прогрессирование стеноза устья аорты за 3-летний период (137). Интересно то, что
пациенты в этом исследовании имели высокую степень склероза аортального клапан,
определенную компьютерной томографией. В исследование включались пациенты с
умеренным и тяжелым СУА, который распознавался на основании пика градиента
аортального клапана (48 - 50 мм рт.ст.), площади аортального клапана (1.02 -
1.03 см2) и максимальной скорости кровотока (3.39 - 3.45 м/с).
Возможно, что процесс
склерозирования был слишком выражен у этих пациентов, что бы быть достаточно
измененным краткосрочной терапией статинами. Таким образом, необходимы
дальнейшие исследования пациентов с менее тяжелым склерозом аортального
клапана, с более длительными периодами лечения. Вместе с тем, оценка и
модификация факторов риска очень важны у пациентов с пороком аортального
клапана для предотвращения сопутствующего ИБС.
3.1.4.5. Физическая
активность и нагрузка
Рекомендации по
физической активности основаны на клиническом исследовании, с особым акцентом
на тяжесть гемодинамических изменений. Тяжесть можно оценить с помощью
допплероэхокардиографии, но в сомнительных случаях, диагностическое
зондирование сердца может быть необходимо для точного определения степени
стеноза.
Рекомендации по участию в спортивных
соревнованиях были изданы Task Force on Acquired
Valvular Heart Disease of the 36th Bethesda Conference (138). Физическая деятельность
не ограничена у бессимптомных пациентов с легким СУА; эти пациенты могут
участвовать в спортивных соревнованиях. Пациенты с умеренным и тяжелым СУА
должны избегать участия в спортивных соревнованиях, которые требуют высокой
динамической и статической мускульной активности. Другие формы нагрузки могут
выполняться, но желательно провести у таких пациентов нагрузочный тест прежде,
чем они начнут тренироваться.
3.1.5. Показания для
зондирования сердца
Класс I
1. Коронарная
ангиография рекомендуется перед ПАК у пациентов с СУА с риском ИБС (см. раздел
10.2). (Уровень доказанности: B)
2. Зондирование сердца
для гемодинамических измерений рекомендуется для оценки тяжести СУА у
симптомных пациентов, когда неинвазивные тесты являются неубедительными или
когда есть несоответствие между неинвазивными тестами и клинически полученными
данными относительно тяжести СУА. (Уровень доказанности: C)
3. Коронарная
ангиография рекомендуется перед ПАК у пациентов с СУА, которым легочной
аутотрансплантант (процедура Росса)
показан, и, если состояние коронарных артерий не было изучено
неинвазивной техникой. (Уровень доказанности: C)
Класс III
1. Зондирование сердца
для гемодинамических измерений не рекомендуется для оценки
тяжести СУА перед ПАК,
когда неинвазивные тесты адекватны и согласуются с клинически полученными
данными. (Уровень доказанности: C)
2. Зондирование сердца
для гемодинамических измерений не рекомендуется для оценки функции ЛЖ и тяжести
СУА у бессимптомных пациентов. (Уровень доказанности: C)
У пациентов с СУА показания для
зондирования сердца и ангиографии - по существу одни и те же, а именно, оценка
коронарного кровообращения и подтверждение или установление клинического
диагноза. Для подготовки к ПАК коронарная ангиография показана у пациентов
подозрительных на ИБС, как обсуждено в разделе 10.2. Если клинические и
эхокардиографические данные типичны для тяжелого изолированного СУА, коронарная
ангиография может быть достаточна перед ПАК. Комплексное лево- и
право-сердечное зондирование может быть необходимо для оценки гемодинамической
тяжести СУА, если есть несоответствие между клиническими и эхокардиографическими
данными.
Градиент давления через стенозированный
клапан связан с площадью отверстия клапана и трансклапанным потоком (139). Таким образом, при
уменьшенном сердечном выбросе у пациентов с тяжелым СУА может быть относительно
низкий градиент давления. С другой стороны, в течение нагрузки или другого
состояния с высокоскоростным потоком
значительный градиент давления может быть измерен в минимально
стенозированном клапане. По этим причинам, комплексная оценка СУА предполагает
• измерение трансклапанного потока
• определение среднего трансклапанного градиента
давления
• вычисление эффективной площади клапана.
Внимание к деталям точного измерения давления и потока является очень
важным, особенно в пациентах с низким сердечным выбросом или низким
трансклапанным градиентом давления.
3.1.6. Аортальный стеноз
Low-Flow/Low-Gradient (низкий поток/низкий
градиент)
Класс IIa
1. Добутаминовая
стресс-эхокардиография показана для оценки пациентов с low-flow/low-gradient СУА и дисфункцией ЛЖ.
(Уровень доказанности: B)
2. Зондирование сердца
для гемодинамических измерений с инфузией
добутамина показана для оценки
пациентов с low-flow/low-gradient СУА и дисфункцией ЛЖ. (Уровень доказанности: C)
У пациентов с тяжелым СУА и низким
сердечным выбросом часто определяется относительно низкий трансклапанный
градиент давления (то есть, средний градиент меньше 30 мм рт. ст.). Таких
пациентов трудно дифференцировать от
пациентов с низким сердечным выбросом, но с легким или умеренным СУА. В первом
случае (истинный анатомически тяжелый СУА), стеноз приводит к повышению
постнагрузки, уменьшению фракции изгнания и низкому ударному объему. В
последнем, первичная сократительная
дисфункция приводит к уменьшению фракции изгнания и низкому ударному объему;
проблема в дальнейшем осложняется ограничением подвижности клапана и кажущимся
стенозированием. В обоих случаях, состояние
низкий потока/низкий градиент давления отражаются на расчетной
эффективной площади клапана, которая может удовлетворять критерию тяжелого СУА.
Альтернативные методы определения тяжести СУА прелагались как менее зависимые
от потока, чем градиенты или площадь клапана. Они включают сопротивляемость
клапана и потерю работы удара. Однако, эти методы все-таки зависят от потока,
не имеют прогностического значения и не распространены в клинической практике (140).
У отдельных пациентов с low-flow/low-gradient СУА и дисфункцией ЛЖ
показано определение трансклапанного градиента давления и вычисление
площади клапана в покое и во время
физической нагрузки или низко-дозовой
фармакологической (то есть, инфузии добутамина) пробы с целью определения
степени стеноза (тяжелый или только умеренный) (123,141–147). Такие исследования
могут быть выполнены в лаборатории эхокардиографии или в лаборатории зондирования
сердца. Этот подход основан на представлении, что у пациентов без истинного
анатомически тяжелого стеноза произойдет увеличение площади клапана и небольшие
изменения градиента при увеличении ударного объема (141, 142). Таким образом, если
инфузия добутамина приводит к возрастанию ударного объема и увеличение площади
клапана больше чем на 0.2 см2 и к небольшим изменениям градиента, то вероятно,
что тяжесть стеноза была завышена. Напротив, у пациентов с тяжелым СУА будет
фиксированная площадь клапана при повышении ударного объема и увеличении
градиента. У этих пациентов, вероятно,
будет хороший прогноз при хирургической коррекции. Если не происходит повышение
ударного объема при инфузии добутамина (меньше чем на 20 %), это называется
“недостаток сократительного резерва”, то у таких больных, вероятно, будет очень
плохой прогноз и при медикаментозной терапии и при хирургическом вмешательстве (2, 148). Проба с добутамином
у пациентов с СУА должна
выполняться только в центрах, имеющих
опыт в проведении фармакологических стресс-проб, в присутствии кардиолога.
Клинический подход к пациенту с СУА и
низким сердечным выбросом основывается на интеграции данных многих
исследований. Оцениваются допплеровская скорость потока, градиент, площадь
клапана, степень клапанного склероза. При тяжелом склерозе показано ПАК. Когда
трансторакальная эхокардиография недостаточно информативна, чрезпищеводная
эхокардиография или флюорография могут применяться для оценки степени
клапанного склероза и площади уплотнения. Риск хирургического вмешательства и
осложнения также должны быть приняты во внимание.
Хотя у пациентов с
тяжелым СУА и низким сердечным выбросом плохой прогноз, все же у тех, у кого
сохранен сократительный резерв прогноз лучше при ПАК, чем при консервативной терапии (148). Некоторым пациентам с
недостатком сократительного резерва также показано ПАК, но показания у этих пациентов высокого риска должны быть
индивидуализированы, потому что нет никаких данных, указывающих на преимущество
хирургического лечения.
3.1.7. Показания для
протезирования аортального клапана
Класс I
1. ПАК показано
симптоматическим пациента с тяжелым СУА*. (Уровень доказанности: B)
2. ПАК показано
пациентам с тяжелым СУА*, подлежащих аорто-коронарному шунтированию (АКШ). (Уровень
доказанности: C)
3. ПАК показано
пациентам с тяжелым СУА*, подлежащих
операции на аорте или на других
клапанах сердца. (Уровень доказанности: C)
4. ПАК рекомендуется
пациентов с тяжелым СУА* и систолической дисфункцией ЛЖ (фракция выброса меньше
0.50). (Уровень доказанности: C)
Класс IIa
ПАК показан пациентам с
умеренным СУА*, подлежащих АКШ или операции на аорте или на других клапанах
сердца (см. Раздел 3.7 о комбинированных сложных пороках сердца и Раздел 10.4 о
ПАК у пациентов подлежащих АКШ). (Уровень доказанности: B)
Класс IIb
1. ПАК можно обсуждать
для бессимптомных пациентов с тяжелым СУА* и патологическим нагрузочным тестом
(например, появление симптомов или бессимптомная гипотензия). (Уровень
доказанности: C)
2. ПАК можно обсуждать
для взрослых пациентов с бессимптомным тяжелым СУА*, если есть высокая
вероятность быстрого прогрессирования болезни (возраст, склероз и ИБС) и если
операция не может быть отсрочена до времени появления симптомов. (Уровень
доказанност: C)
3. ПАК можно обсуждать
для пациентов подлежащих АКШ с легким СУА *, когда есть свидетельства такие,
как умеренный и тяжелый склероз клапана, что прогрессирование заболевания может
быть быстрым. (Уровень доказанности: C)
4. ПАК можно обсуждать
для бессимптомных пациентов с критически тяжелым СУА (площадь аортального
клапана меньше 0.6 см2, средний градиент больше 60 мм рт.ст. и
максимальная скорость кровотока больше 5.0 м/с), когда ожидаемая
послеоперационная летальность пациента
- 1.0 % или меньше. (Уровень доказанности: C)
Класс III
ПАК не показано и не предотвращает
внезапную смерть у бессимптомных пациентов с СУА не имеющих данных,
перечисленных в рекомендациях под классами IIa-IIb.
(Уровень доказанности:
B)
*Смотрите Таблицу 4 (27).
У взрослых пациентов с тяжелым, симптомным, кальцифицированным
СУА, ПАК является
единственным эффективным
лечением. Юные пациенты с врожденным или ревматическим СУА могут быть
кандидатами на вальвулотомию (см. Раздел 6.1, лечение подростков и юных
взрослых). Хотя нет единого мнения об оптимальном выборе времени операции у
бессимптомных пациентов, для большинства пациентов можно определить
рациональные руководящие принципы. Стратегия лечения пациентов с тяжелым СУА представлена на рис. 3 (149). Частные вопросы анамнеза, осмотра, операционного риска и послеоперационного
исхода у бессимптомных пациентов смотрите также в Разделе 7.2.
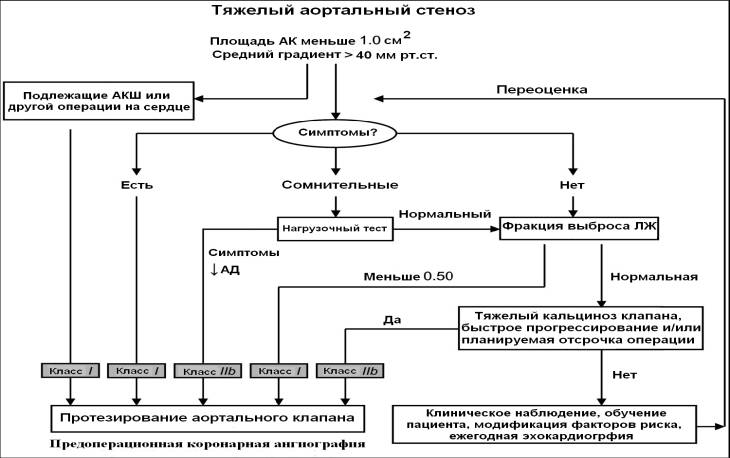
Рис. 3
3.1.7.1. Симптомные
пациенты
У симптомных пациентов с
СУА, ПАК улучшает симптомы и повышает выживаемость (106,150–155). Положительные
результаты операции частично зависят от функции ЛЖ. Исход операции одинаков
как у пациентов с
нормальной функцией ЛЖ, так и у пациентов с умеренным снижением сократительной
функции. Сниженная фракция выброса у многих пациентов в последней группе
вызвана чрезмерной постнагрузкой (afterload mismatch) (66), и функция ЛЖ улучшается после ПАК у
таких пациентов. После
ПАК, если дисфункция ЛЖ не была вызвана чрезмерной постнагрузкой, выживаемость повышается, но восстановление функции ЛЖ и исчезновение симптомов
полностью не происходит (150,154,156–158). Поэтому, при отсутствии серьезных осложнений
ПАК показано фактически всем симптомным пациентам с тяжелым СУА. Для снижения
риска внезапной смерти ПАК должно быть выполнено сразу после появления
симптомов. Возраст не является противопоказанием к
операции, в нескольких
исследованиях показаны результаты
сходные с сопоставимыми по возрасту здоровыми лицами в очень пожилом возрасте. Операционный риск может быть
оценен быстро и достаточно точно онлайн
на сайтах Society of Thoracic Surgeons
(www.sts.org)
и European System for Cardiac Operative Risk Evaluation (www.euroscore.org) (159–161), так же точно как по Ambler et al. (162).
3.1.7.2. Бессимптомные
пациенты
Многие клиницисты
неохотно проводят ПАК у бессимптомных пациентов (163), некоторые вообще стараются обойтись без
хирургического вмешательства. Хотя ПАК сопровождается низкой послеоперационной
заболеваемостью и смертностью во многих центрах, средняя послеопреационная
летальность в базе данных STS от 3.0 % до 4.0 % для изолированного ПАК и от 5.5
% до 6.8 % для ПАК плюс АКШ(164,165).
Эта частота
на 33 % выше в центрах с низким объемом,
чем в центрах с самым высоким объемом операций (166). Обзор Medicare data (167), включающий 684 больницы
США
и больше 142 000
пациентов, сообщает о 8,8% внутрибольничной летальности для ПАК у пациентов в
возрасте 65 лет (13.0 %
в центрах с низким объемом и 6.0 % в центрах с большим объемом). Кроме того,
несмотря на сравнительно высокую долговечность текущего поколения биопротезных
клапанов
(168,169) ПАК у молодых пациентов
сопроводается риском разрушения биопротезов
(168,170–
174) и заметного
увеличения заболеваемости и смертности
при механических клапанах (172,174–178). Таким образом, комбинированный риск операции у пожилых
пациентов и поздние осложнения
протезов у молодых
должен быть уравновешен возможностью предупреждения внезапной смерти, частота
которой меньше 1.0 % ежегодно.
Все-таки, среди клиницистов сохраняется
некоторое различие точек зрения на показания к ПАК
у бессимптомных
пациентов с тяжелым СУА, потому что вероятность дальнейшего бессимптомного
течения заболевания без операции меньше
50 % за 5 лет
(61 96 116).
Некоторые исследователи утверждают, что в течение длительной бессимптомной
стадии развивается необратимая миокардиальная недостаточность или фиброз. Такая
необратимость не быда доказана, но это понятие использовалось для обоснования
ранней операции (152 179). Делаются попытки идентифицировать пациентов с очень высоким
риском внезапной смерти без операции, хотя данных для этого недостаточно. В
настоящее время общепринято, что у бессимптомных пациентов с тяжелым СУА с
нормальной систолической функцией ЛЖ риск ПАК превышает любой другой вариант
лечения. Однако, по мере усовершенствования протезов и развития методов безопасной замены клапана
выбор лечения может
измениться в пользу более раннего оперативного вмешательство при СУА.
Исследования показывают, что пациенты могут быть стратифицированы по
риску быстрого прогрессирования заболевания и появления симптомов на основании
клинических и эхокардиографических параметров. Гемодинамическте изменения
наступаю быстрее у пациентов
с бессимптомным тяжелым (96) или от легкого до
умеренного
(98) СУА,
когда возраст пациента превышает 50 лет и есть тяжелый склероз клапана или
сопутствующая ИБС. Неблагоприятные клинические результаты наиболее вероятны у
пациентов с прогрессирующими гемодинамическими изменениями, определяемыми как
увеличение максимальной аортальной скорости кровотока больше чем на 0.3 м/с ежегодно или уменьшение площади клапана
больше чем 0.1 см2 ежегодно (61,96). Наличие гипертрофии левого
желудочка на ЭКГ и уменьшенная допплерэхокардиографическая площадь
аортального клапана являются предикторами появления симптомов (61 116). Также, уровень
сыворотки B-типа натрийуретического пептида может давать важную прогностическую
информацию
(180). В
тех случаях, когда есть задержка между появлением симптомов и хирургическим
вмешательством пациенты имеют высокий риск неблагоприятного прогноза в течение
периода ожидания. Этим пациентам высокого риска показана более частая
эхокардиография или
более ранняя замена
клапана.
В 1998 ACC/AHA
Guidelines for the Management of Patients with Valvular Heart Disease было рекомендовано выполнение
ПАК у пациентов с СУА и резкой гипертрофией ЛЖ и у таких же пациентов с
желудочковой тахикардией (Класс IIb). Текущий комитет
посчитал это недостаточно обоснованным
и не включит в настоящий документ.
.
3.1.7.3. Пациенты
подвергающиеся аортокоронарному шунтированию или другой операции на сердце
Пациенты с тяжелым СУА,
с симптомами или без симптомов, которые подлежат АКШ, должны подвергнуться ПАК
во время процедуры замены кровеносных сосудов. Точно так же, пациенты с
тяжелым СУА, подлежащих
операции на других клапанах (например,
митральной вальвулопластике) или корне аорты, должны также подвергнуться ПАК как часть хирургической процедуры.
У пациентов с умеренным СУА выполнение ПАК во время АКШ является общепринятой
практикой,
(181–185). Многие клиницисты
также рекомендуют ПАК при умеренном СУА во время операции на МК или на корне
аорты (для детального уточнения см. Раздел 3.7, “Сложный клапанный порок”).
Однако, нет никаких
данных, чтобы рекомендовать ПАК при
легком СУА во время АКШ, за исключением пациентов с умеренным и тяжелым
клапанным склерозом (кальцификацией)
(98,181,182,185–187). Рекомендации для ПАК во время АКШ обсуждены в
Разделе 10.4.
3.1.8.
Аортальная баллонная вальвулотомия
Класс IIb
1. Аортальная баллонная вальвулотомия может применяться как
этапная операция у гемодинамически нестабильных взрослых пациентов с СУА с
высоким риском для ПАК. (Уровень доказанности: C)
2. Аортальная баллонная вальвулотомия может приименяться как
паллиативная операция у взрослых пациентов с СУА, у которых ПАК не может быть выполнено из-за серьезных осложнений. (Уровень
доказанности: C)
Класс III
Аортальная баллонная вальвулотомия не рекомендуется как
альтернатива ПАК у взрослых пациентов с СУА;
исключение составляют некоторые юные пациеты без кальцификации клапана
(см. Раздел 6.1.3). (Уровень доказанности: B)
Чрезкожная баллонная
аортальная вальвулотомия - процедура,
когда 1 или более баллонов устанавливаются
в стенозированный клапан и раздуваются, чтобы уменьшить тяжесть СУА (188-
190). Эта процедура играет важную роль в лечении подростков и юных
взрослых с СУА (см. Раздел 6.1.), но очень ограничена у взрослых. Механизм
уменьшения стеноза у взрослых пациентов состоит в разрушении кальциевых
включений в створках клапана и, в меньшей степени, в растяжении кольца и в
разделении кальцифицированных или спаянных комиссур (191-193). Ближайшие гемодинамические
результаты включают умеренное снижение трансклапанного градиента
давления, но площадь клапана после вальвулотомии редко превышает 1.0 см2. Раннее симптоматическое улучшение обычно наступает несмотря на
небольшие изменения площади клапана. Однако, серьезные острые осложнения встречаются с частотой больше чем
10 % (194-200), и у
большинства пациентов рестеноз и
клиническое ухудшение встречаются в течение 6 - 12 месяцев после вмешательства
(195 200-204).
Поэтому, у взрослых пациентов с СУА баллонная вальвулотомия не
заменяет ПАК (204-207).
Некоторые клиницисты утверждают, что
несмотря на послепроцедурную заболеваемость и смертность и ограниченные
долгосрочные результаты баллонная вальвулотомия может иметь временную (этапную)
роль в лечении некоторых симптомных пациентов, которые не могут первоначально
подвергнуться ПАК (207). Например, пациентам с СУА и рефрактерным отёком легких или
кардиогенным шоком может быть показана аортальная вальвулопластика как
"мост" к операции; улучшение гемодинамики может уменьшить риск
операции. Однако, большинство клиницистов рекомендует непосредственное ПАК в
этих случаях. Показания к паллиативной вальвулотомии у пациентов, которым не рекомендовано ПАК
из-за серьезных осложнений, не достаточно установлены и нет данных по
увеличению у них продолжительности жизни. Хотя некоторые пациенты действительно
сообщают об уменьшении симптомов. Большинству бессимптомных пациентов с тяжелым
СУА, которым требуется срочная несердечная операция, она может быть проведена
при разумно низком риске с мониторированием анестезии, электролитного и
кислотно-щелочного
равновесия (208–212). Баллонная аортальная
вальвулотомия не рекомендуется этим пациентам. Если предоперационная коррекция
СУА необходима, необходимо рассмотреть ПАК.
3.1.9. Медикаментозная
терапия у неоперабeльного пациента
При сопутствующих
осложнениях (например, малигнизация) или при других обстоятельствах
пациент предпочитает
отказаться от ПАК при тяжелом СУА. В этом случае нет медикаментозного лечения,
которое продлевает жизнь, и консервативное лечение только облегчает
симптомы. Пациентам с легочным застоем
о надо начинать лечение с осторожного назначения дигиталиса, диуретиков и
ингибиторов ангиотензинпревращающего фермента (АПФ). Действительно, осторожное
уменьшение объема циркулирующей крови и преднагрузки ЛЖ могут быть эффективны у
некоторых пациентов с симптомами сердечной недостаточности. Но, чрезмерное
уменьшение преднагрузки может понизить сердечный выброс и снизить системное
артериальное давление; пациенты с тяжелым
СУА особенно подвержены этому неблагоприятному эффекту из-за небольшого
гипертрофированного желудочка. У
пациентов с острым отёком легких вследствие СУА, инфузия нитропруссида
может уменьшить застой и работу ЛЖ.
Такое лечение должно проводиться в блоке интенсивной терапии под инвазивным
гемодинамическим контролем (213). Дигиталис применяется у пациентов с пониженной
систолической функцией или фибрилляцией предсердий. Фибрилляция предсердий и
другие предсердные аритмии имеют неблагоприятный эффект на предсердную насосную
функцию и частоту желудочковых
сокращений. Если немедленная кардиоверсия неэффективна, то необходим фармакологический контроль частоты
сокращений желудочков. Если стенокардия является основным симптомом, то
показано осторожное назначение нитратов и бета-блокаторов. При обмороке, если
он не вызван бради- или тахиартмией,
какой-либо специфической терапии нет.
3.1.10. Оценка после протезирования
аортального клапана
Принимая во внимание
известные осложнения протезирования аортального клапана (168 170-178 214), пациентам необходимы
периодические клинические и лабораторные обследования после ПАК. Полный анамнез
и осмотр должны проводиться, по крайней мере, один раз в год. Показания для
эхокардиографии обсуждены в Разделе 9.3.
3.1.11. Особенности
пожилых пациентов
Поскольку нет никакой
эффективной медикаментозной терапии при СУА, и баллонная вальвулотомия не
приемлема как альтернатива операции, ПАК необходимо рекомендовать всем пожилым
пациентам, которые имеют симптомы обусловленные СУА. Замена клапана технически
возможна в любом возрасте (215), но решение о проведении такой операции зависит от многих
факторов, включая желание пациента. У пожилых пациентов с симптомами,
вызванными СУА, с нормальными коронарными
артериями и с сохраненной функцией ЛЖ результат операции лучше, чем у
пациентов с ИБС или с дисфункцией ЛЖ (110). Конечно злокачественная опухоль и постоянные
неврологические дефекты в результате инсульта или слабоумие делают операцию на
сердце ненужной. Декомпенсированные и истощенные пациенты часто не возвращаются
к активному состоянию, и присутствие других осложнений имеют основное
влияние на прогноз.
Помимо сочетанного влияния ИБС и
возможного инсульта, некоторые другие состояния являются свойственными для
пожилых пациентов. Например, узкий тракт оттока ЛЖ и маленькое аортальное
кольцо иногда бывают у пожилых женщин, и может
понадобиться расширение кольца. Тяжелая
кальцификация клапана, кольца и корня аорты может потребовать
разрушения. Иногда,
показано комплексное аорта-клапанное протезирование. Опять-таки, чрезмерная или неадекватная гипертрофия, вызванная
клапанным стенозом, может быть маркером для послеоперационной
заболеваемости и
смертности
(81,83).
Предоперационная подготовка пожилых пациентов с заметной гипертрофией ЛЖ, сопровождаемая
соответствующим интраоперационным лечением может существенно уменьшить эту
заболеваемость и смертность. Нет хорошего метода учета всех достоверных
факторов для определения высокого и низкого риска всех пожилых пациентов, но
этот риск может быть оценен достаточно точно хорошо у конкретного пациента (159-162 216). Решение провести ПАК
зависит от приблизительного анализа равновесия между вероятностью развития
симптомов и выживания и операционной заболеваемостью и смертностью (217–219).
3.2. Аортальная регургитация
3.2.1.
Этиология
Наиболее частыми причинами АР
являются идиопатическое расширение аорты, врожденные пороки аортального клапана (наиболее встречающийся
двустворчатый клапан), склеротическая дегенерация, ревматизм, инфекционный эндокардит, системная гипертензия,
миксоматозная дегенерация, расслоение восходящей аорты и синдром Марфана. Менее
частые причины включают травматические
повреждения аортального клапана, анкилозирующий спондилит, сифилитический
аортит, ревматоитдный артрит, деформирующий остеоартроз, гигантоклеточный
аортит, синдром Ehlers-Danlos, синдром Рейтера, непостоянный субаортальный стеноз, и
дефект межжелудочковой
перегородки с пролапсом аортального клапана. По последним сообщениям,
аноректические препараты также могут вызвать АР (см.
Раздел 3.9.). Большинство этих причин приводят к хронической АР с постепенной и
скрытой дилатацией ЛЖ и с длительной бессимптомной фазой (Таблица 4) (27). Другие причины, в
частности инфекционный эндокардит, расслоение аорты и травма, чаще приводят к
острой тяжелой АР, которая может вызвать внезапное катастрофическое повышение давления наполнения ЛЖ и снижение
сердечного выброса.
3.2.2. Острая аортальная
регургитация
3.2.2.1. Патофизиология
При острой тяжелой АР на
левый желудочек нормального размера действует внезапный большой объем
регургитации, и левый желудочек не имеет времени приспособиться к перегрузке
объемом. С резким увеличением конечно-диастолического объема желудочек работает
на крутой части кривой отношения
диастолическое давление - объем, и конечное диастолическое давление ЛЖ и
давление в
левом предсердии могут
увеличиться быстро и драматично. Механизм Франка-Старлинга имеет место, но
неспособность желудочка компенсировать дилатацию полости быстро приводит к
уменьшению ударного объема. Тахикардии, которая развивается как компенсаторный
механизм, чтобы поддержать сердечный выброс, часто недостаточно для такой
компенсации.
Следовательно, пациентов
часто ожидает отёк легких или
кардиогенный шок. Острая АР вызывает
особенно выраженные гемодинамические изменения у пациентов с
существовавшей ранее
гипертрофией от
перегрузки давлением, с маленькой неподатливой полостью ЛЖ, и установленным на
еще более крутой части отношением
диастолическое давление - объем и уменьшенным резервом преднагрузки. В качестве примеров для этой
последней ситуации можно привести расслоение аорты у пациентов с системной
гипертензией, инфекционный эндокардит у пациентов с существовавшим ранее СУА и
острую регургитацию после баллонной вальвулотомии или хирургической
комиссуротомии при врожденном СУА. У пациентов могут быть также симптомы ишемии миокарда. Поскольку
конечно-диастолическое давление ЛЖ приближается к диастолическому давлению в
аорте и в коронарных артериях, давление
миокардиальной перфузии в субэндокарде уменьшается. Дилатация ЛЖ и утончение
стенки ЛЖ из-за увеличения постнагрузки в сокдинении с тахикардией приводит к
увеличению потребности миокарда в кислороде. Поэтому, при острой тяжелой АР
часто бывают ишемия и ее последствия, включая внезапную смерть.
3.2.2.2. Диагноз
Многие из характерных
симптомов хронической АР изменяются или отсутствуют при острой клапанной
регургитации, что может привести к недооценке тяжести заболевания. Размеры ЛЖ
могут быть нормальными при осмотре, и кардиомегалия может отсутствовать на
рентгенографии грудной клетки. Пульсовое давление может быть не увеличено,
потому что систолическое давление уменьшено и аортальное диастолическое
давление уравновешивается увеличенным диастолическим давлением в ЛЖ. Если этот
диастолический баланс давления между аортой и желудочком наступает перед концом
диастолы, диастолический
шум может быть коротким и/или мягким и, поэтому плохо выслушиваемым. Повышение
диастолического давления в ЛЖ закрывает МК преждевременно, уменьшая таким
образом интенсивность первого тона
сердца. Может выслушиваться верхушечный диастолический шум, обычно короткий и
без предсистолического усиления. Тахикардия присутствует всегда.
Эхокардиография обязательна для
подтверждения клапанной регургитации и оценки ее тяжести; определяется причина
регургитации, оценивается степень легочной гипертензии (если есть ТР), определяется, есть ли быстрое равновесие
аортального давления и диастолического
давления ЛЖ. Свидетельством быстрого баланса давления являются короткий
полупериод диастолической АР (меньше
300 мс), короткое митрального замедления (меньше 150 мс), преждевременное
закрытие МК.
Острая АР, вызванная расслоением корня
аорты – неотложная хирургическая патология, требующая особенно быстрой
диагностики лечения. При подозрении на расслоение аорты показана чрезпищеводная
эхокардиография (220–222). В некоторых случаях должны быть выполнены компьютерная
томография или магнитно-резонансная томография, если это приведет к более
быстрому диагнозу, чем применение чрезпищеводной эхокардиографии (220,221,223). Зондирование сердца, аортография и
коронароангиография требуются редко,
так как связаны с увеличенным риском и могут излишне задержать срочную операцию
(221,224–227). Ангиографию нужно рассматривать только тогда,
когда диагноз не может быть установлен с помощью неинвазивной визуализации, и
когда у пациентов достоверно определена ИБС (особенно пациенты, перенесшие АКШ)
(см. Раздел 10.2).
3.2.2.3. Лечение
Смерть из-за отёка
легких, желудочковых аритмий, электромеханической диссоциации или
циркуляторного коллапса является частой при острой тяжелой АР, даже при
интенсивной медикаментозной терапии. Рекомендуется срочное хирургическое
вмешательство. На короткое время перед операцией могут быть назначены
нитропруссид и, возможно, инотропные
агенты типа допамина или добутамина для увеличения кровотока и уменьшения
конечно-диастолического давления. Внутриаортальная баллонная контрпульсация
противопоказана. Хотя бета-блокаторы
часто используются для
лечения расслоения аорты, эти препараты должны использоваться очень осторожно в
лечении острой АР, потому что они блокируют компенсаторную тахикардию.
У пациентов с острой
тяжелой АР вследствие инфекционного эндокардита операция не должна быть
отсрочена, особенно если есть гипотония, отёк легких или признаки низкого
сердечного выброса. У пациентов с легкой острой АР достаточно назначения
антибиотиков, если пациент гемодинамически стабилен. Исключения к последней
рекомендации обсуждены в Разделе 4.6.1.
3.2.3. Хроническая
аортальная регургитация
3.2.3.1. Патофизиология
При хронической АР левый
желудочек отвечает на перегрузку объемом рядом компенсационных механизмов,
которые включают увеличение конечно-диастолического объема, увеличение камерной
податливости, что приводит к увеличению объема без повышения давления
наполнения ЛЖ и комбинации эксцентрической и концентрический гипертрофии.
Увеличенный диастолический объем позволяет желудочку изгонять больший ударный
объем, сохраняя его размеры в нормальном
диапазоне. Это
достигается перестановкой миокардиальных волокон с прибавлением новых
саркомеров и развитием эксцентрической гипертрофии ЛЖ (228). В результате, преднагрузка
на уровне саркомера остается нормальной или близко к нормальной, и желудочек
сохраняет преднагрузочный резерв. Увеличенный ударный объем достигается нормальной работой каждой
сократительной единицы вдоль увеличенной окружности (229). Таким образом, работа
изгнания ЛЖ остается нормальной, и показатели фазы изгнания, такие как фракции
изгнания и фракционное укорочение остаются в нормальных пределах. Однако,
увеличение размера камеры, и, связанное с ним повышение систолического
пристеночного напряжения, в свою очередь приводит к увеличению
постнагрузки ЛЖ, что
является стимулом для дальнейшей гипертрофии (228,230). Таким образом, АР создает условия для комбинации
перегрузки объемом и перегрузки давлением (231). По мере прогрессирования болезни пополнение
преднагрузочного резерва и компенсаторная гипертрофия дают возможность
желудочку поддерживать нормальный выброс несмотря на повышение постнагрузки (232 233). Большинство пациентов
остаются бессимптомными на протяжении фазы
компенсации, которая может продолжаться в течение многих десятилетий.
Сосудорасширяющая
терапия дает возможность
уменьшить гемодинамическое бремя у таких пациентов.
В последующем обсуждении пациенты с
нормальной систолической функцией будут определены как пациенты с нормальной
фракцией изгнания ЛЖ в покое. Общепризнано, что другие показатели функции ЛЖ могут не быть
"нормальными" при хронической
тяжелой АР, и, что гемодинамические
отклонения, как выше было отмечено, могут быть значительными. Также
признано, что переход от нормальной функции к систолической дисфункции ЛЖ
представляет собой континуум (т.е., является непрерывным) и, нет единственного
гемодинамического измерения, которое показывает абсолютную
границу между нормальной
систолической функцией ЛЖ и систолической дисфункцией ЛЖ.
У большого процента пациентов равновесие
между приростом постнагрузки и преднагрузочным резервом с одной стороны и гипертрофией с другой не может
поддерживаться неопределенно долго.
Преднагрузочный резерв может быть исчерпан (233), и/или гипертрофический
ответ может быть неадекватным (63), так что дальнейшее увеличение постнагрузки приводит к уменьшению
фракции изгнания сначала к нижней границе нормы и затем ниже нормы. Снижение
сократимости миокарда
может также внести свой
вклад в этот процесс. У пациентов часто возникает одышка в этой точке развития
болезни. И, дополнительно, уменьшенный коронарный резерв в гипертрофированном
миокарде может привести к стенокардии
напряжения (234).Однако, этот переход
может быть намного более коварным, и пациенты могут не остаться бессимптомными до развития тяжелой дисфункции ЛЖ.
Систолическая дисфункция ЛЖ
(определенная, как снижение фракции изгнания ниже нормальной в покое) – это первоначально обратимое
явление, связанное преимущественно с приростом постнагрузки. Полное
восстановление размеров ЛЖ и функции
возможно после ПАК (235–246). Со временем, в течение
которого развивается прогрессирующее расширение камеры и левый желудочек
приобретает более сферическую форму, снижается сократимость миокарда из-за
чрезмерной нагрузки, что приводит к прогрессирующей систолической дисфункции.
Прогрессирование заболевания может дойти до той степени, когда хороший
результат операции (восстановление функции ЛЖ, повышение выживаемости) уже не
может быть достигнут (244,247–256).
В большинстве исследований показано, что
систолическая функция ЛЖ и конечно-систолический размер являются самыми важными детерминантами выживаемости и
послеоперационной функции ЛЖ у пациентов
подлежащих ПАК при хронической АР (235,237–267). Исследования предикторов результата операции перечислены в Таблице 13.
Среди пациентов, подвергающихся
протезированию клапана при хронической АР с предоперационной систолической
дисфункцией ЛЖ (определенная как фракция изгнания ниже нормальный в покое),
некоторые факторы связаны с худшим результатом (функция ЛЖ, выживаемость) после
операции. Они перечислены в Таблице 14.
3.2.3.2. Анамнез
3.2.3.2.1. БЕССИМПТОМНЫЕ ПАЦИЕНТЫ С
НОРМАЛЬНОЙ
ФУНКЦИЕЙ ЛЕВОГО ЖЕЛУДОЧКА. Нет действительно крупномасштабных исследований, оценивающих анамнез бессимптомных пациентов,
у которых систолическая функция была определена как нормальная (по результатам
инвазивных или неинвазивных методов). Текущие рекомендации основаны на
результатах 9 опубликованных исследований (268–277), в которые было вовлечено в общей
сложности 593 пациента ( 27 - 104 пациента/исследование) со средним периодом
наблюдения 6.6 лет (Таблица 15). Этот анализ ограничен обычными недостатками, когда сравниваются
клинические исследования
с принципами отбора
пациентов и различными конечными точками. Например, 1 серия наблюдений (270) представляет пациентов, получавших плацебо в
рандомизированном медикаментозном исследовании (278), куда было включено несколько пациентов с функциональным классом II
по NYHA (хотя ни один не имел "лимитирующих"
симптомов). В другой серии (272) представлены пациенты, получающие дигоксин в долгосрочном
исследовании, сравнивающим эффекты нифедипина и дигоксина. В 2 исследованиях (274,276) о функции ЛЖ не сообщается и неясно, имели ли все
пациенты нормальную систолическую
функцию ЛЖ изначально. В другом исследовании (275) 20 % пациентов не были бессимптомными, а имели
симптомы "раннего" функционального класса II по NYHA;
присутствие этих симптомов было специфическим предиктором смерти и дисфункции
ЛЖ, или развивались более тяжелые симптомы. Некоторые пациенты в этом последнем
исследовании имели существенную систолическую дисфункцию ЛЖ (фракционное
укорочение около 18 %).
Результаты этих 9 исследований суммированы
в
Таблицах15
и 16. Частота
прогрессирования симптомов и/или систолической дисфункции ЛЖ составляла в
среднем 4.3 % ежегодно. Внезапная смерть случалась у 7 из 593 пациентов, средняя смертность меньше 0.2 % ежегодно. В
7 из 9 исследований сообщалась частота развития бессимптомной дисфункции ЛЖ,
которая определялась как фракция изгнания в покое ниже нормальный (269-273 275 276); у 37 из 535 пациентов
появилось снижение систолическую функцию в покое без симптомов на протяжении в
среднем 5.9-летнего последующего периода, 1.2 % ежегодно.
Таблица 13. Предоперационные предикторы результатов операции при аортальной
регургитации
Исследование,
год Дизайн Число Оценка Полученные данные
исследования
пациентов результата
Forman et al., 1980 (251) Ретроспективное 90 Выживание Группа высокого риска идентифицировалась с помощью
предоперационной ангиографии (ФВ ЛЖ меньше 0.50)
Henry et al., 1980 (257) Проспективное
50 Выживание Группа высокого риска
идентифицировалась с помощью
предоперационной
эхокардиографии (ФУ ЛЖ меньше 0.25
и/или КСР больше 55 мм.
Cunha et al., 1980 (250) Ретроспективное 86 Выживание Группа высокого риска идентифицировалась с помощью
предоперационной эхокардиографии ФУ ЛЖ менее 0.30.
. Смертность
также значимо была связана с
предоперационным
КСР. Среди пациентов с ФУ меньше
0.30 смертность
выше при ФК III–IV по NYHA, чем
при ФК
I–II.
Greves et al., 1981 (252) Ретроспективное 45 Выживание Группа высокого риска идентифицировалась с помощью
предоперационной ангиографии (ФВ ЛЖ меньше 0,45 и/или
СИ меньше 2,5 л/мин/м. Среди пациентов с ФВ меньше 0.45
смертность выше при ФК III–IV по NYHA, чем
при ФК I–II.
Kumpuris et al., 1982 (258) Проспективное
43 Выживание, Постоянная дилатация ЛЖ после ПАК, предсказанная
сердечная предоперационной
эхокардиографией (КСР ЛЖ,
среднее
недостаточность, соотношение
радиус/толщина и конечно-систолическое
функция
ЛЖ пристеночное напряжение. Все смертельные случаи
произошли у
пациентов с постоянной дилатацией ЛЖ.
Gaasch et al., 1983 (253) Проспективное 32 Симптомы,
Постоянная дилатация ЛЖ, предсказанная
Функция
ЛЖ эхокардиографией (КСР ЛЖ
больше 2.6 см/м2 и
отношение
радиус/толщина больше 3.8. Тенденция к снижению
выживаемости у пациентов с постоянной дилатацией ЛЖ.
Fioretti et al., 1983 (259) Ретроспективное 47 Функция
ЛЖ Постоянная дисфункция ЛЖ,
предсказанная
предоперационным КДР 75 мм или больше и/или КСР 55
мм или больше.
Stone et al., 1984 (260) Проспективное
113 Функция ЛЖ Нормальная функция ЛЖ после ПАК,
предсказанная
предоперационным ФУ ЛЖ больше 0.26,
КСР меньше
55 мм
и КДР меньше 80 мм. Никакой
дооперационный показатель
не
предсказал послеоперационную функцию ЛЖ.
Bonow et al., 1985, 1988
(254,245) Проспективное 80 Выживание, Послеоперационная
выживаемость и функция ЛЖ,
функция ЛЖ предсказанные
предоперационными ФВ ЛЖ, ФУ ЛЖ и КСР
ЛЖ. Группа высокого риска идентифицировалась на
основании
субнормальной ФВ в покое. Среди
пациентов с
субнормальной ФВ,
низкой толерантностью к физической
нагрузке и длительным периодом
дисфункции ЛЖ
выделялась группа наибольшего риска.
Daniel et al., 1985 (261) Ретроспективное 84 Выживание, Результат ПАК,
предсказанный предоперационными ФУ ЛЖ
симптомы, и КСР. Выживаемость за 2.5 года
составила 90.5% с ФУ
функция ЛЖ больше 0.25 и КСР
55 мм или меньше,
но только 70% с КСР
больше 55 мм и ФУ 25% или меньше.
Cormier et al., 1986 (262) Проспективное 73 Выживание
Группа высокого риска идентифицировалась на основании
предоперационной
ФВ ЛЖ меньше 0.40 и КСР 55 мм или
больше.
Sheiban et al., 1986 (263) Ретроспективное 84 Выживание Группа
высокого риска выделялась на основании
предоперационной ФВ ЛЖ меньше 0.50
и КСР больше 55 мм.
Carabello et al., 1987 (243) Ретроспективное 14 Функция ЛЖ Послеоперационная ФВ ЛЖ,
предсказанная
предоперационными
КСР, ФУ, КДР и
отношением
радиус/толщина.
Taniguchi et al., 1987 (244) Ретроспективное 62 Выживание Группа высокого риска
выделялась предоперационной КСО
больше 200 мл/м2 и/или ФВ меньше 0.40.
Michel et al., 1995 (256) Ретроспективное 286 Функция ЛЖ Послеоперационная дисфункция ЛЖ, предсказанная
предоперационными ФВ ЛЖ,
ФУ, КСД и КДР.
Klodas et al., 1996, 1997
Ретроспективное
289 Выживание Группа высокого риска выделялась
на основании тяжести
(264,265) симптомов
и предоперационной ФВ меньше 0.50.
Turina et al., 1998 (266) Ретроспективное 192 Выживание Группа высокого риска выделялась на основании
тяжести
симптомов, низкой
ФВ и увеличения конечно-
диастолического объема.
Tornos et al., 2006 (267) Проспективное 170 Выживание Группа высокого риска выделялась на
основании тяжести
симптомов, низкой
ФВ и увеличении КДР и КСР.
ПАК
обозначает протезирование аортального клапана; СИ, сердечный
индекс; КДР, конечный диастолический размер;
ФВ, фракция
выброса; КСР, конечный систолический размер;
КСО, конечный
систолический объем; ФК, функциональный класс;
ФУ, фракционное
укорочение; ЛЖ, левый желудочек; NYHA, New York Heart Association.
Таблица 14. Факторы, предсказывающие уменьшение послеоперационной
выживаемости и восстановления функции левого желудочка у
пациентов с аортальной регургитацией и предоперационной систолической
дисфункцией левого желудочка
Тяжесть
предоперационных симптомов или снижение толерантности к физической
нагрузке
Тяжесть снижения
фракции выброса левого желудочка
Продолжительность
предоперационной систолической дисфункции левого желудочка
Таблица 15. Исследования анамнеза бессимптомных пациентов с аортальной регургитацией
Исследование, год
Число Средняя Прогрессирование Прогрессирование
Пациентов продолжительность симптомов, смерть бессимптомной
наблюдения, г или
дисфункция ЛЖ, дисфункции ЛЖ Смертность,
% за
год
--------------------------
число
n % за год
пациентов Комментарии
Bonow et al., 1983, 1991 104 8.0 3.8 4 0.5 2
Результат
(268,271)
предсказывался КСР,
КДР
ЛЖ, динамикой
ФВ при нагрузке и
динамикой
КСР и ФВ
в
покое
Scognamiglio et al., 1986* 30 4.7 2.1 3 2.1 0
У 3 пациентов,
(269)
имевших ранее
сниженное отношение
ДЛА/КСО, развилась
бессимптомная
дисфункция
ЛЖ,
повысились
КСР и КДР
ЛЖ и снизилось ФУ
Siemienczuk et al., 1989 50 3.7 4.0 1 0.5 0 В плацебо
(270)
контролируемое
рандомизированое
исследование
было
включено
несколько
пациентов с
ФК II по NYHA;
результат
прогнозировался КСО,
КДО ЛЖ, динамикой
ФВ
при нагрузке и
конечно-ситолическим
пристеночным
напряжением
Scognamiglio et al., 1994* 74 6.0 5.7 15 3.4 0
Все пациенты получали
(272)
дигоксин как часть
рандомизированного
исследования
Tornos et al., 1995 101 4.6 3.0 6 1.3 0
Результат
(273)
прогнозировался по
пульсовому давлению,
КСР, КДР и ФВ ЛЖ
Ishii et al., 1996 27 14.2 3.6 - - 0 Развитие симптомов
(274) прогнозировалось
по
систолическому
АД,
КСР
ЛЖ, КДР,
индексу массы и
толщине стенки ЛЖ.
Не сообщалось о
Функции ЛЖ у всех
пациентов
Borer et al., 1998 104 7.3 6.2 7 0.9 4
20% пациентов с ФК
(275)
II по NYHA; прогноз
проводился
по
изначальным
симптомам II ФК,
динамике ФВ ЛЖ
при
нагруке, КСР ЛЖ
и
ФУ ЛЖ
Tarasoutchi et al., 2003 72 10 4.7
1 0.1 0 Развитие симптомов
(276)
прогнозировалось
КСР и КДР ЛЖ.
О
функции
ЛЖ у всех
пациентов
не
сообщалось
Evangelista et al., 2005 31 7 3.6 - - 1
Плацебо
(277)
контролируемая
группа в 7-летнем
клиническом
исследовании
вазодилататоров
Всего (в среднем)
593 6.6 4.3
37 1.2 0.18% за год
Прочерк
обозначает, что данные не известны.
*В два исследования тех же авторов вовлечены отдельные группы пациентов.
АД
обозначает артериальное давление; КДР, конечный диастолический размер; КДО, конечный диастолический объем;
ФВ, фракция
выброса; КСР, конечный систолический размер;
КСО, конечный
систолический объем; ФК, функциональный класс;
ФУ, фракционное
укорочение; ЛЖ, левый желудочек; NYHA, New York Heart Association;
ДЛА, давление
в легочной артерии.
Несмотря на низкий
процент пациентов, у которых развивается бессимптомная дисфункция ЛЖ, надо подчеркнуть, что больше чем одна четверть
пациентов умирают или у них прогрессирует систолическая дисфункция перед
появлением симптомов (269–271,275).
Таким
образом, полный посимптомный опрос пациентов не является достаточным для оценки
бессимптомных пациентов; количественная оценка функции ЛЖ таких пациентов
обязательна. Кроме того, пациенты с риском появления симптомов, смерти, или
дисфункции ЛЖ могут быть также идентифицированы на основе неинвазивного
тестирования. Пять из анамнестических исследований дают согласующуюся
информацию относительно показателей, ассоциирующих с более высоким риском (270-272, 275, 276).
Эти показатели -
возраст, конечный систолический размер (или объем) ЛЖ, конечный
диастолический размер (или объем) ЛЖ и
фракция выброса ЛЖ в течение нагрузки. В 1-м исследовании (275),
фракция выброса в
течение нагрузки была независимым фактором риска. Однако, направление и
величина изменения фракции изгнания от начальной в покое до пика нагрузки
связана не только с
сократимостью миокарда (279), но и с тяжестью
перегрузки объемом (271,278–280), и с вызванными нагрузкой изменениями в преднагрузке, и с
периферическим сопротивлением (280). В 2-х многомерных анализах (271, 276) только возраст и конечный систолический размер в начале
исследования были независимыми предикторами прогноза, так же как частота
увеличения конечного
систолического размера и
снижение фракции выброса в покое на протяжении серийных продолжительных
исследований
(271). В
течение периода наблюдения в среднем 8 лет пациенты с начальным конечным
систолическим размером больше 50 мм имели вероятность смерти, симптомов и/или дисфункцию ЛЖ 19 % ежегодно. У
пациентов с конечным систолическим размером 40 - 50 мм эта вероятность была 6 %
ежегодно, и когда размер был меньше 40 мм, вероятность была ноль (271).
3.2.3.2.2. БЕССИМПТОМНЫЕ ПАЦИЕНТЫ
СО СНИЖЕННОЙ СИСТОЛИЧЕСКОЙ ФУНКЦИЕЙ.
Немногочисленные данные
о бессимптомных пациентах со сниженной
фракцией изгнания ЛЖ показывают, что большинство симптомов, которые гарантируют
ПАК, развиваются в течение 2 - 3 лет
(281–283). Средняя
частота появления симптомов у таких пациентов более 25 % ежегодно (Таблица 16) (268–277,281–288).
3.2.3.2.3. СИМПТОМНЫЕ ПАЦИЕНТЫ. Нет современных
крупномасштабных анамнестических исследований
симптомных пациентов с хронической АР, потому что начало стенокардии или
значительной одышки обычно является показанием для замены клапана. Данные,
полученные в дохирургическую эру, показывают, что пациенты с одышкой,
стенокардией или явной сердечной недостаточностью, получающие медикаментозную
терапию, имеют плохой прогноз
аналогичный таковому у пациентов с симптомным СУА. Сообщают о смертности больше 10 % за год у пациентов со
стенокардией и больше 20 % за год у пациентов с сердечной недостаточностью (284–286). Функция ЛЖ не
определялась у этих пациентов, таким образом, неясно симптомные пациенты с
нормальной фракцией выброса имеют ли такой же неблагоприятный прогноз, как и
симптомные пациенты с дисфункцией ЛЖ; однако, последующие данные указывают на
плохой прогноз для симптомных пациентов, получающих медикаментозную терапию,
даже с сохраненной систолической функцией ЛЖ
(274,287,288).
3.2.3.3. Диагноз и
предварительная оценка
Класс I
1. Эхокардиография
показана для подтверждения наличия и тяжести острой или хронической АР. (Уровень доказанности: B)
2. Эхокардиография
показана для диагноза и оценки причины хронической АР (включая
морфологию клапана,
морфологию и размер корня аорты) и для оценки гипертрофии, размера (или объема)
и систолическая функция ЛЖ. (Уровень доказанности: B)
3. Эхокардиография
показана пациентам с расширением корня аорты для оценки регургитации и тяжести
аортальной дилатации. (Уровень доказанности: B)
4. Эхокардиография
показана для периодической переоценки размеров и функции ЛЖ у бессимптомных
пациентов с тяжелой АР. (Уровень доказанности: B)
5. Радионуклидная
ангиография или магнитно-резонансная томография показаны для начальной и последующей оценки объемов и
функции ЛЖ в покое у пациентов с АР и неоптимальными эхокардиограммами.
(Уровень доказанности: B)
6. Эхокардиография
показана для переоценки легкой, умеренной или тяжелой АР у пациентов с новыми
или измененными симптомами. (Уровень доказанности: B)
Класс IIa
1. Нагрузочные тесты при
хронической АР могут быть показаны для оценки функциональной возможности и
симптомного ответа у пациентов с анамнезом сомнительных симптомов. (Уровень доказанности:
B)
2. Нагрузочные тесты у
пациентов с хронической АР могут быть показаны для оценки симптомов и
функциональной возможности перед участием в спортивных соревнованиях.
(Уровень доказанности:
C)
3. Магнитно-резонансная
томография может быть показана для оценки тяжести АР у пациентов с неудовлетворительными эхокардиограммами.
(Уровень доказанности: B)
Класс IIb
Нагрузочный тест с
радионуклидной ангиографией может быть рассмотрен для оценки функции ЛЖ у
бессимптомных или симптомных пациентов с хронической АР. (Уровень
доказанности: B)
Диагноз хронической тяжелой АР обычно
ставится на основании диастолического шума, смещения пульсации ЛЖ, увеличенного
пульсового давления и характерных
периферических симптомов, отражающих
большое пульсовое давление. Третий тон сердца часто выслушивается как
проявление перегрузки объемом, а не обязательно как признак сердечной
недостаточностица. Шум Остина-Флинта – специфичный признак тяжелой АР (289 290). У многих пациентов с
АР от легкой до умеренной осмотр может
определить регургитацию, но будет менее точным в определении ее тяжести. Когда
диастолический шум АР громче в третьем и четвертом межреберье справа, чем в
третьем и четвертом межреберье слева, АР вероятнее всего является следствием расширения корня
Аорты, чем только деформации створок (291). Рентгенография органов
грудной клетки и ЭКГ могут быть полезны в оценке размеров сердца и ритма,
определения гипертрофии ЛЖ и нарушений проводимости.
Эхокардиография показана
•, чтобы подтвердить
диагноз АР, если диагноз, основанный на данных осмотра, сомнителен
•, чтобы оценить причину
АР и оценить морфологию клапана
•, чтобы обеспечить
полуколичественную оценку тяжести АР
•, чтобы оценить
размеры, массу и систолическую функцию ЛЖ
•, чтобы оценить размер
корня аорты.
У бессимптомных пациентах с сохраненной
систолической функцией эти начальные показатели представляют основную информацию, с которой будут сравниваться
результаты последующих исследований. В опытных лабораториях в дополнение к
полуколичественной оценке тяжести АР (определение площади и ширины потока
цветной доплеровской эхокардиографией) может быть выполнено количественное
измерение объема регургитации, фракции регургитации и регургитационной площади
отверстия (Таблица 4) (27). Также могут быть
полезны косвенные методы оценки тяжести АР: степень снижения градиента
регургитации, измеренная наклоном графика скорости диастолического потока,
степень реверсии пульсовой скорости пульсовой волны в нисходящей аорте и
величине скорости кровотока в тракте оттока ЛЖ (2, 292, 293). Сравнение ударного
объема, вычисленного на основании кровотока через аортальный клапан, с ударным
объемом, определенным по кровотоку в другом интактном клапане, позволяет
количественно определить фракцию регургитации (294), но технически более сложное.
Пристеночное напряжение ЛЖ может быть оценено по артериальному давлению
и эхокардиографическим измерениям. Однако, такое определение пристеночного
напряжения трудно воспроизвести, имеет методологические и концептуальные
проблемы и не может применяться для диагностики и лечения в клинической
практике.
В целях последующего обсуждения лечения
пациентов с АР, тяжелую АР определим как клинически и допплерографически
доказанную тяжелую регургитацию (Таблица 4) (27) в сочетании с дилатацией полости ЛЖ. Если
пациент бессимптомный, ведет активный образ жизни и эхокардиография выполнена качественно, никаких других
исследований не требуется. Если у пациента тяжелая АР и он ведет малоподвижный
образ жизни или имеет сомнительные симптомы, нагрузочный тест может быть полезным для оценки функциональной
возможности, симптомного ответа и гемодинамических эффектов нагрузки (рис. 4). Если эхокардиография
не позволяет качественно оценить функцию ЛЖ
у бессимптомного пациента, то показана радионуклидная ангиография
или магнитно-резонансная томография
сердца для измерения фракции выброса ЛЖ в покое и оценки объемов ЛЖ. У
симптомных пациентов при первичной оценке
разумно перейти непосредственно к чрезпищеводной
эхокардиографии или к зондированию сердца и ангиографии, если
эхокардиография не может достаточно точно оценить функцию ЛЖ или тяжесть
АР.
Фракция выброса на высоте нагрузки и
динамика фракции выброса от базальной до нагрузочной часто патологическая, даже у бессимптомных пациентов (268,
270–272,275,283,295–303). Однако, не было доказано, что это имеет независимую
диагностическую или прогностическую ценность, когда функция ЛЖ в покое и тяжесть перегрузки объемом ЛЖ,
определенная эхокардиографически, уже известны. В одном исследовании (в которое
было включено много пациентов с симптомами II ФК по NYHA, систолической
дисфункцией ЛЖ (фракционное укорочение 18 % и ниже) и выраженной дилатацией ЛЖ
(конечно-диастолический и конечно-систолический размеры выше 87 мм и 65 мм, соответственно)), определялась фракция выброса ЛЖ при нагрузке как
предиктор симптомного ухудшения или дисфункции ЛЖ (275). Следовательно, прогностическая ценность такого ответа у
бессимптомных пациентов с нормальной систолической функцией и без выраженной
дилатации ЛЖ
достоверно не изучалась.
Таблица 16. Анамнез аортальной регургитации
Бессимптомные пациенты с
нормальной систолической функцией ЛЖ (268–277)
Прогрессирование к симптомам и/или к
дисфункции ЛЖ меньше 6 % в год
Прогрессирование к бессимптомной дисфункции
ЛЖ
меньше 3.5 % в год
Внезапная смерть
меньше 0.2 % в год
Бессимптомные пациенты с
дисфункцией ЛЖ
(281–283)
Прогрессирование к сердечным симптомам
больше 25 % в год
Симптомные пациенты (284–288)
Смертность
больше 10 % в год
ЛЖ – левый желудочек.
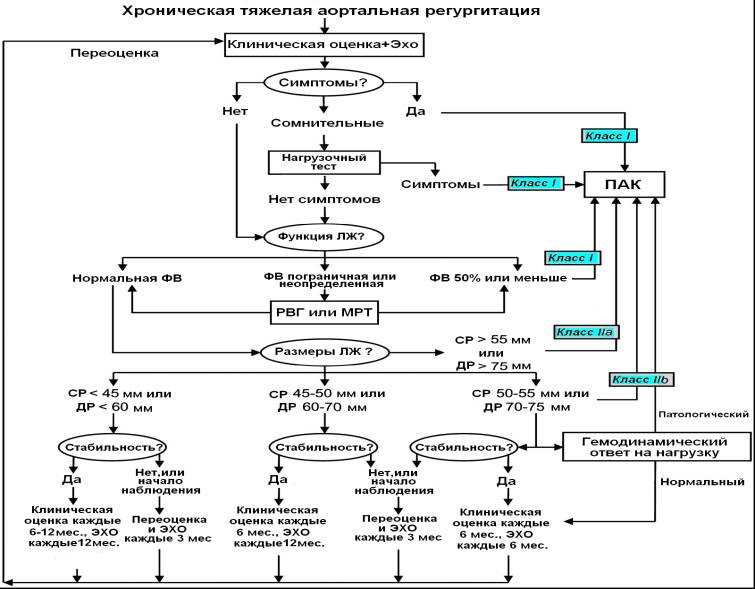
Рис 4
3.2.3.4. Медикаментозная терапия
Класс I
Лечение вазодилататорами показано
для постоянной терапии пациентам с тяжелой АР, у которых есть симптомы или
дисфункция ЛЖ, когда операция не рекомендуется из-за дополнительных сердечных или
внесердечных факторов. (Уровень доказанности: B)
Класс IIa
Лечение вазодилататорами может быть
рекомендовано для краткосрочной терапии
с целью улучшения гемодинамического
профиля пациентов с симптомами тяжелой сердечной недостаточности и тяжелой дисфункции ЛЖ перед ПАК. (Уровень
доказанности: C)
Класс IIb
Лечение вазодилататорами может быть
рассмотрено для длительной терапии бессимптомным пациентам с тяжелой АР, имеющим дилатацию ЛЖ и нормальную
систолическую функцию.
(Уровень доказанности: B)
Класс III
1. Лечение вазодилататорами не
показано для длительной терапии у бессимптомных пациентов с легкой и умеренной
АР и нормальной систолической функцией ЛЖ. (Уровень
доказанности: B)
2. Лечение вазодилататорами не
показано для длительной терапии у бессимптомных пациентов с систолической
дисфункцией ЛЖ, которым может быть проведено ПАК.
(Уровень доказанности: C)
3. Лечение вазодилататорами не
показано для длительной терапии у симптомных пациентов с нормальной функцией ЛЖ
или умеренной систолической дисфункцией ЛЖ, которым может быть проведено ПАК. (Уровень
доказанности: C)
Терапия вазодилататорами разработана для увеличения ударного объема и
уменьшения объема регургитации. Эти эффекты должны привести к снижению
конечного диастолического объема ЛЖ, пристеночного
напряжения и постнагрузки, что, в свою очередь, ведет к восстановлению и
сохранению систолической функции ЛЖ и уменьшению массы ЛЖ. Острая
фармакологическая проба с нитропруссидом натрия, гидралазином, нифедипином или
фелодипином уменьшает периферическое сосудистое сопротивление и приводит к
увеличению сердечного выброса и
уменьшению объема регургитации
(304–313).
Острые гемодинамические изменения после введения нитропруссида и
гидралазина приводят к постепенному уменьшению конечного диастолического объема
и увеличения фракции выброса (304-306 312). Подобное
наступает не постепенно, а сразу после приема внутрь разовой дозы
нифедипина (308–311). Уменьшение конечного диастолического объема и увеличение фракции выброса
наблюдались также у небольшого числа пациентов, получавших внутрь гидралазин и
нифедипин за период 1 - 2 года (278 314); для нифедипина эти
эффекты связаны с
уменьшением массы ЛЖ (272 314). Менее определенные
результаты сообщают о воздействии игибиторов АПФ на снижение артериального
давления и уменьшение конечного диастолического объема (315–317). Снижение артериального давления эналаприлом и квинаприлом
сопровождалось уменьшением конечного диастолического объема и массы, но фракция
выброса не изменилась (316 317).
Можно указать 3 возможные области
применения вазодилататоров при хронической АР. Надо подчеркнуть, что эти
критерии применимы только у пациентов с тяжелой АР. Первая область: длительное
лечение пациентов с тяжелой АР, которые
имеют симптомы и/или дисфункцию ЛЖ и являются маловозможными кандидатами на операцию из-за дополнительных
сердечных или внесердечных факторов. Вторая – улучшение гемодинамического
профиля пациентов с симптомами тяжелой сердечной недостаточности и с тяжелой
дисфункцией ЛЖ краткосрочной терапией вазодилятаторами перед проведением ПАК.
Надо избегать применения вазодилататоров с
отрицательным инотропным эффектом у таких пациентов. Третья - продление
фазы компенсации у бессимптомных пациентов, имеющих перегрузку объемом левый
желудочек при нормальной систолической
функции.
Возможность этого последнего эффекта была
исследована только в 2 исследованиях. В первом проспективном рандомизированном
исследовании сравнивались нифедипин пролонгированного действия с дигоксином (272). За 6-летний период в
группе пациентов, принимавших нифедипин, число пациентов, нуждающихся в ПАК
из-за симптомов или развития дисфункции ЛЖ (фракция выброса меньше 0.50),
уменьшилось. В это исследование было
включено относительно небольшое число пациентов (143 пациента), конечные точки
были немногочисленные (20 пациентов в группе дигоксина и 6 в группе нифедипина
подверглись ПАК) и не было группы плацебо контроля. В более позднем исследовании сравнивалось плацебо, нифедипин
пролонгированного действия и эналаприл у 95
пациентов, которые наблюдались в течение 7 лет (277). Ни нифедипин, ни
эналаприл не уменьшали развитие симптомов или дисфункции ЛЖ, предвещающих ПАК,
по сравнению с плацебо. Кроме того, ни один из препаратов значительно не
изменял размер ЛЖ, фракцию выброса и массу
ЛЖ в процессе наблюдения по сравнению с плацебо. Таким образом, категорические
рекомендации относительно показаний для нифедипина пролонгированного действия
или ингибиторов АПФ не могут быть сделаны в настоящее время.
Если применяется лечение вазодилататорами,
цель которых состоит в том, чтобы уменьшить систолическое артериальное
давление, то доза препарата должны контролироваться степенью снижения
артериального давления или возможным появлением побочных эффектов. Редко возможно
уменьшить систолическое
артериальное давление до нормального из-за увеличенного ударного объема, и доза
препарата не должна увеличиваться чрезмерно в попытке достигнуть этой цели.
Преимущества
вазодилататоров неизвестны, и лечение вазодилататорами не показано пациентам с
нормальным артериальным давлением или нормальными размерами полости ЛЖ.
Терапия вазодилататорами не рекомендуется
бессимптомным пациентам с легкой или умеренной АР и нормальной функцией ЛЖ в
отсутствии системной гипертензии, потому что эти пациенты имеют хороший прогноз
и без терапии. У бессимптомных или симптомных пациентов с тяжелой АР и
систолической дисфункцией лечение вазодилятаторами не может быть альтернативой
операции. Если ПАК не противопоказано
из-за дополнительных сердечных или внесердечных факторов, такие пациенты должны
быть кандидатами на операцию, а не кандидатами на долговременную
медикаментозную терапию. У симптоматических пациентов с сохраненной
систолической функцией пока не определено, что лучше: агрессивное
медикаментозное лечение или ПАК. Симптоматическим пациентам рекомендуют
операцию чаще, чем долговременную медикаментозную терапию.
Есть скудная информация о долгосрочной
лечении другими группами препаратов помимо
вазодилататоров у
бессимптомных пациентов с тяжелой АР и нормальной функцией ЛЖ. Таким образом,
нет никаких данных о пользе долговременного применения дигоксина, диуретиков,
нитратов
и положительных инотропных
препаратов у бессимптомных пациентов, и
нет данных относительно любых препаратов у пациентов с легкой или умеренной АР.
3.2.3.5. Физическая
активность и нагрузка
Нет никаких данных,
подтверждающих, что нагрузка, особенно энергичная периодическая нагрузка,
вносит свой вклад или ускоряет прогрессирование дисфункции ЛЖ при АР.
Бессимптомные пациенты с нормальной систолической функцией могут участвовать во
всех формах нормальной ежедневной физической деятельности, включая умеренные
виды нагрузки и, в некоторых случаях, состязательную легкую атлетику. Изометрической нагрузки надо избегать.
Рекомендации относительно участия в конкурентоспособной легкой атлетике были
изданы the Task Force on Acquired Valvular Heart
Disease of the 36th Bethesda Conference (138). Перед занятием
легкой атлетикой рекомендуется определить толерантность пациента к
физической нагрузке. Не обязательно
оценивать
Долговременные эффекты
энергичной нагрузки, которые не изучались.
3.2.3.6.Наблюдение в
динамике
Цель динамического
наблюдения бессимптомных пациентов с хронической АР - обнаружить начало
симптомов и объективно оценить изменения размеров и функции ЛЖ. Последнее может
произойти и в отсутствии симптомов. При первоначальном обращении к врачу должны
быть установлены хронический характер и степень стабильности регургитационного
повреждения и ответ ЛЖ на перегрузку объемом, особенно при АР от умеренной к
сильной. Если хронический характер повреждения представляется сомнительным, и
нет ни одного показания для операции, необходимо повторить осмотр и
эхокардиографию через 2 - 3 месяца для исключения подострого процесса.
Если хронический характер
и стабильность процесса установлены, то частота повторных клинических
осмотров и повторных
неинвазивных исследований зависят от тяжести клапанной регургитации, степени
дилатации ЛЖ, состояния систолической функции и какую динамику размеров и
функции ЛЖ показали предыдущие (рис. 4). У большинства пациентов динамическое наблюдение в течение длительного периода должно
включать детальный анамнез, осмотр и эхокардиографию. Рентгенография органов
грудной клетки и ЭКГ в динамике имеют меньшую ценность, но полезны у отдельных
пациентов.
Бессимптомные пациенты с легкой АР без или с небольшой дилатацией ЛЖ и с нормальной систолической функцией ЛЖ
могут осматриваться ежегодно с инструкцией сообщать врачу о появлении
симптомов. Ежегодная эхокардиография необязательна
если нет клинических оснований заподозрить ухудшение регургитации. Рутинная
эхокардиография может выполняться каждые 2 - 3 года у таких пациентов.
Бессимптомные пациенты с нормальной
систолической функцией, тяжелой АР и существенной дилатацией ЛЖ (конечный
диастолический размер больше 60 мм) требуют более частой и тщательной
переоценки, сбора анамнеза и осмотра каждые 6 месяцев и эхокардиографии каждые
6 – 12 месяцев, в зависимости от выраженности дилатации и стабильности размеров
ЛЖ. Если пациенты стабильны, нет необходимости проводить эхокардиографию чаще,
чем раз в 12 месяцев. У пациентов с более выраженной дилатацией ЛЖ (конечный
диастолический размер больше 70 мм или конечный систолический размер больше 50
мм), у которых риск появления симптомов или дисфункции ЛЖ находится между 10 %
и 20 % ежегодно (271 272), следует выполнять эхокардиографию каждые 4 - 6 месяцев.
Рентгенография органов грудной клетки и ЭКГ в динамике имеют меньшую ценность,
но полезны у отдельных пациентов.
Хроническая АР может развиться вследствие
вовлечения в болезненный процесс проксимальной части восходящей аорты. У
пациентов с дилатацией корня аорты эхокардиография в динамике показана для
оценки размера корня аорты, так же как и размеров и функции ЛЖ. Это обсуждено в
Разделе 3.2.4.
Повторная эхокардиография также
рекомендуется, когда у пациента появляются симптомы, анамнез динамики симптомов
сомнителен или изменяется толерантность к физической нагрузке,
или появляются
клинические данные о прогрессировании регургитации или дилатации ЛЖ. Пациенты
с эхокардиографическим
данными прогрессирования дилатации желудочка или снижения систолической функции
имеют большую вероятность появления симптомов или дисфункции ЛЖ (271) и должны более часто переобследоваться (каждые 6
месяцев), чем пациенты со стабильной функцией ЛЖ.
В некоторых центрах нуклеарной кардиологии
радионуклидная вентрикулография в динамике может быть более точной и
рентабельной чем эхокардиография для оценки объемов и
функции ЛЖ в покое.
Однако, не оправдано рутинное исследование, включающее как эхокардиографию
так и радионуклидную вентрикулографию. Радионуклидная вентрикулография в
динамике также рекомендуется пациентам
с некачественными эхокардиограммами, пациентам у которых на основании
эхокардиографии заподозрена, но не подтверждена систолическая дисфункция ЛЖ, и
в тех случаях, когда есть разногласия между клинической оценкой и данными
эхокардиографии. В центрах, где проводится магнитно-резонансная томография, это
исследование в динамике может быть выполнено вместо радионуклидной ангиографии
по вышеупомянутым показаниям. Кроме точной оценки объема, массы, толщины стенки
и систолической функции ЛЖ (318–322), магнитно-резонансная томография сердца может использоваться
для количественной оценки тяжести клапанной регургитации (323–327).
Нагрузочные пробы в динамике как рутинное
исследование не рекомендуется проводить бессимптомным пациентам с сохраненной
систолической функцией; однако, нагрузочные пробы весьма полезны в оценке
функциональной возможности и симптомного ответа у пациентов с
Сомнительными
симптомами. Нагрузочные пробы в динамике, позволяющие оценить функциональный
резерв ЛЖ, не показаны бессимптомным пациентам или пациентам, у которых уже
есть симптомы.
3.2.3.7. Показания для зондирования
сердца
Класс I
1. Зондирование сердца с
ангиографией корня аорты и с измерением давления в ЛЖ показано для оценки
тяжести регургитации, функции ЛЖ или определения размера корня аорты, когда
неинвазивные тесты являются неинформативными или противоречат клиническим
данным у пациентов с АР. (Уровень доказанности: B)
2. Коронарная ангиография показана
перед ПАК у пациентов с признаками ИБС. (Уровень доказанности: C)
Класс III
1. Зондирование сердца с
ангиографией корня аорты и с измерением давления в ЛЖ не показано для оценки
функции ЛЖ, определения размера корня аорты или тяжести регургитации перед ПАК,
когда неинвазивные тесты являются адекватными и согласуются с клиническими данными и коронарная ангиография не обязательна. (Уровень
доказанности: С).
2. Зондирование сердца с
ангиографией корня аорты и с измерением давления в ЛЖ не показано для оценки
функции ЛЖ и тяжести регургитации у бессимптомных пациентов, когда неинвазивные
тесты являются адекватными. (Уровень доказанности: C)
Зондирование сердца не требуется у пациентов с хронической АР, если нет
сомнений в тяжести АР, в нарушениях гемодинамики или в наличии систолической
дисфункции ЛЖ, и они не возникают при нагрузочных тестах и неинвазивных
исследованиях или если ПАК не рассматривается, и нет
потребности оценивать коронарную
анатомию. Показания для коронарографии обсуждены в Разделе 10.2. У
некоторых пациентов, подвергающихся лево-сердечному зондированию для
коронарографии,
дополнительные ангиография корня
аорты и гемодинамические измерения могут дать полезные дополнительные данные.
Гемодинамическая и ангиографическая оценка тяжести АР и функции ЛЖ может
быть необходима у некоторых пациентов, которым показана операция, когда данные
клиники и неинвазивных тестов противоречивы. Реже, бессимптомным пациентам,
которым не показана операция, может также потребоваться инвазивное определение
показателей гемодинамики и/или определение тяжести АР
(только тогда, когда эта информация
не может быть получена достаточно точно при неинвазивных исследованиях).
Определение показателей гемодинамики при выполнении физической нагрузки
иногда полезно для определения действия АР на функцию ЛЖ и принятия решения
относительно медикаментозного или хирургического лечения. У отдельных пациентов
с тяжелой АР, пограничной или нормальной систолической функцией ЛЖ и дилатацией
камеры ЛЖ это помогает определить показания для операции (приводятся ниже).
Определение величины сердечного выброса и давления наполнения ЛЖ в покое и в течение нагрузочного теста с
право-сердечным катетером может быть ценным для идентификации пациентов с
выраженными гемодинамическими нарушениями, которым показана операция.
3.2.3.8. Показания для
протезирования аортального клапана или аортальной вальвулопластики
Большинство пациентов с
тяжелой АР, требующей операции, подвергаются замене клапана (см. Раздел 7.2.).
Однако, в некоторых хирургических центрах увеличивается число операций
аортальной вальвулопластики (см. Раздел 7.2.6.). В обсуждении, которое
последует, термин «ПАК» относится и к протезированию аортального клапана и к
пластике аортального клапана с пониманием, что пластику аортального клапана можно рекомендовать
только в тех хирургических центрах, которые имеют
развитый соответствующее
техническое оснащение и опыт в отборе пациентов, и показывают результаты эквивалентные таковым при
протезировании клапана. Показания для протезирования клапана такие же как и для
пластики.
У пациентов с чистой хронической АР ПАК
рассматривается только, если АР тяжелая (Таблица 4) (27). Пациенты с только легкой АР не являются
кандидатами для ПАК и, если такие пациенты имеют симптомы или дисфункцию ЛЖ
необходимо рассмотреть другие причины, типа ИБС, гипертензии или
кардиомиопатии. Если
тяжесть АР не определена после анализа клинических и эхокардиографических
данных, дополнительная информация может быть получена из инвазивных
гемодинамических и ангиографических данных. Следующее обсуждение касается
только пациентов с чистой тяжелой АР.
Класс I
1. ПАК показано (-а)
симптомным пациентам с тяжелой АР независимо от систолической функции ЛЖ.
(Уровень доказнности: B)
2. ПАК показано (-а)
бессимптомным пациентам с хронической тяжелой АР и систолической дисфункцией ЛЖ
(фракция выброса 0.50 или меньше) в покое. (Уровень доказанности:B)
3. ПАК показано (-а)
пациентам с хронической тяжелой АР, подвергающихся АКШ или операции на аорте
или на других сердечных клапанах. (Уровень доказанности: C)
Класс IIa
ПАК может быть показано
(-а) бессимптомным пациентам с тяжелой АР с нормальной систолической функцией ЛЖ (фракция выброса
больше 0.50), но со значительной дилатацией ЛЖ (конечный диастолический размер
больше 75 мм или конечный систолический размер больше 55 мм).* (Уровень
доказанности: B)
Класс IIb
1. ПАК может быть
рассмотрено (-а) у пациентов с умеренной АР, которые подлежат операции на
восходящей аорте. (Уровень доказанности: C)
2. ПАК может быть
рассмотрено (-а) у пациентов с умеренной АР, которые подлежат АКШ. (Уровень
доказанности: C)
3. ПАК может быть
рассмотрено (-а) у бессимптомных пациентов с тяжелой АР и нормальной систолической функцией ЛЖ в покое (фракция
выброса больше 0.50), когда степень дилатации ЛЖ достаточно выражена (конечный
диастолический размер превышает 70 мм или конечный систолический размер
превышает 50 мм), когда есть признаки прогрессирования дилатации ЛЖ, когда
уменьшается толерантность к физической нагрузке или имеется патологический
гемодинамический ответ на нагрузку.* (Уровень доказанности: C)
Класс III
ПАК не показано (-а) бессимптомным пациентам с
легкой, умеренной или тяжелой АР и нормальной систолической функцией ЛЖ в покое
(фракция выброса больше 0.50), когда степень дилатции невыраженная (конечный
диастолический размер меньше 70 мм, конечный
систолический размер
меньше 50 мм).* (Уровень доказанности: B)
*Учесть понижающие коэффициенты
пациентам маленького роста.
3.2.3.8.1. СИМПТОМНЫЕ ПАЦИЕНТЫ С
НОРМАЛЬНЫМ ЛЕВОЖЕЛУДОЧКОВОЙ СИСТОЛИЧЕСКОЙ ФУНКЦИЕЙ. ПАК показано (-а) пациентам с нормальной систолической
функцией ЛЖ (определенной как фракция выброса больше 0.50 в покое), которые имеют симптомы функционального класса III
или IV по NYHA. Операция показана пациентам, имеющим
стенокардию от II до IV функционального класса по Canadian Heart
Association.
У многих пациентов с одышкой II функционального класса по NYHA
причина симптомов
является часто неясной и
требуется клиническая оценка. Пациенты с хорошо компенсированной АР часто имеют
хроническую умеренную одышку или усталость, и
трудно отдифференцировать
эффекты детренированности или возраста от истинных сердечных симптомов.
Проба с физической нагрузкой у таких пациентов может быть весьма ценной. Если
причина этих умеренных симптомов недостаточно ясна, и они не очень серьезно
конфликтуют с образом жизни пациента, разумно просто понаблюдать за пациентом
какое-то время. Однако, острое появление умеренной одышки имеет другое значения
при тяжелой АР, особенно у пациентов с увеличением размеров полости ЛЖ
или факт снижения
систолической функции ЛЖ ниже нормы. Таким образом, даже если у пациентов
размеры и функция ЛЖ не достигли пороговых величин, рекомендованных для
операции у бессимптомных пациентов, появление умеренных симптомов является
показанием для ПАК.
3.2.3.8.2. СИМПТОМНЫЕ ПАЦИЕНТЫ С ДИСФУНКЦИЕЙ ЛЕВОГО ЖЕЛУДОЧКА.
Пациенты с симптомами
II, III, или IV функционального класса по NYHA и с от легкой до
умеренной систолической дисфункцией ЛЖ (фракция выброса от 0.25 до 0.50) должны
подвергнуться ПАК. Пациенты с симптомами IV функционального класса по NYHA
имеют худшую постоперационную частоту выживания и более низкую вероятность
восстановления систолической функции чем пациенты с менее серьезными симптомами (245 250 252 254), но ПАК улучшит условия
нагрузки желудочка и ускорит последующее восстановление функции ЛЖ (238).
Тяжелые симптомные пациенты (IV
функциональный класс по NYHA) с выраженной
дисфункцией ЛЖ (фракция выброса меньше 0.25 и/или конечный систолический размер
больше 60 мм) трудно поддаются лечению. Некоторые пациенты показывают
достоверное восстановление функции ЛЖ после ПАК, но у многих развиваются
необратимые изменения в миокарде. Смертность, связанная с заменой клапана,
приближается к 10 %, и послеоперационная смертность, даже за последние
несколько лет, высока. Замена клапана должна быть рассмотрена более
настоятельно у пациентов с симптомами II и III функционального класса по NYHA,
особенно если
• симптомы и проявления дисфункции ЛЖ появились
недавно;
• интенсивная кратковременная терапия
вазодилятаторами и диуретиками приводит к симптомному
улучшению;
• внутривенные положительные инотропные препараты
приводят к существенному улучшению
гемодинамики или систолической функции.
Однако, даже у пациентов с симптомами IV
функционального класса по NYHA, фракцией выброса меньше 0.25, высоким риском, связанным с ПАК
и последующим медикаментозным лечением дисфункции ЛЖ, обычно более лучшая альтернатива более высокому риску одного
долговременного медикаментозного лечения (328).
3.2.3.8.3. БЕССИМПТОМНЫЕ ПАЦИЕНТЫ. ПАК у бессимптомных
пациентов - это спорная тема. Но общепринято (233,329–335), что ПАК показано (-а) пациентам с
систолической дисфункцией ЛЖ. Как отмечено ранее, систолическая дисфункция ЛЖ
определяется как фракция выброса ниже нормальной в покое. Предложен нижний
предел нормы 0.50, исходя из понимания, что более низкий предел зависит от
технических возможностей и может изменяться в разных учреждениях. Комитет также
понимает, что может быть вариабельность любых данных измерения размеров ЛЖ или
фракции выброса. Поэтому, комитет рекомендует, чтобы два последовательных
измерения были проведены
прежде, чем будет
принято решение рекомендовать операцию у бессимптомного пациента. Эти
последовательные измерения могут быть получены одним и тем же повторным
исследованием за короткий период (например, повторная эхокардиография после
первичной эхокардиографии), или разными независимыми исследованиями
(например, радионуклидная вентрикулография, магнитно- резонансная томография
или контрастная левожелудочковая вентрикулография после первичной эхокардиографии).
ПАК также рекомендуется пациентам со
значительной дилатацией ЛЖ (конечный диастолический размер больше 75 мм или конечный систолический размер больше 55
мм), даже если фракция выброса нормальная. У большинства пациентов с этой
степенью расширения всегда разовьется систолическая дисфункция из-за неадекватной
постнагрузки и, таким образом, появятся показания для замены клапана на основе
сниженной фракции выброса. Увеличенный конечный систолический размер в этом
отношении - часто заменитель для систолической дисфункции. Относительно
небольшое число бессимптомных пациентов с сохраненной фракцией выброса,
несмотря на значительное увеличение конечного систолического и конечного
диастолического размеров полости, надо
рассматривать как кандидатов на операцию, потому что они составляют группу
риска внезапной смерти (271,336). Результаты замены клапана у таких пациентов до настоящего времени
были очень хорошие (264). Напротив, послеоперационная смертность значительна иногда у
пациентов с резкой дилатацией ЛЖ, симптомами или систолической дисфункцией ЛЖ (264). Рекомендации
относительно риска внезапной смерти и послеоперационных результатов при резкой дилатации ЛЖ были
основаны на сообщениях о внезапной смерти у 2-х из 3-х пациентов с конечным
диастолическим размером ЛЖ больше 80 мм (271) и у 2-х пациентов с конечным диастолическим
индексом объема ЛЖ, больше чем 200 мл/м2 (336). Тем не менее, конечный
диастолический размер, исследованный как непрерывная или как дихотомическая
переменная (меньше 80 против больше 80 мм), не был предиктором
послеоперационного выживания или функции ЛЖ, тогда как фракция выброса является
предиктором. Консервативное лечение пациентов с конечным диастолическим
давлением, превышающим 70 мм, тоже дает благоприятные клинические результаты (276). Эти данные не поддерживают использование резкого
расширения ЛЖ как показание для ПАК, если нет сердечных симптомов или
систолической дисфункции (337). Однако, комитет рекомендует операцию перед тем, как левый
желудочек достигнет чрезвычайной степени дилатации и рекомендует ПАК пациентам
с конечным диастолическим размером больше 75 мм.
Антропометрическую нормализацию конечного
диастолического размера ЛЖ (или объема) нужно рассматривать, но, к сожалению,
не достигнуто соглашения относительно того, действительно ли
нормализация, основанная
на площади поверхности тела или индексе массы тела, влияет на прогноз (288 338). Нормализация конечного
диастолического размера по площади поверхности тела имеет тенденцию скрывать
диагноз расширения ЛЖ, особенно у пациентов, имеющих лишний вес (339). Использование роста и
пола, вероятно, будет более соответствующим, чем площадь поверхности тела (340).
Пациентам с тяжелой АР, у кого степень
дилатации ЛЖ не достигла, но приближается к пороговым
величинам (например,
конечный диастолический размер 70 - 75 мм или конечный систолический размер 50
- 55 мм), необходимо проводить эхокардиографию каждые 4 – 6 месяцев, как
отмечено выше
(рис. 4).
Кроме того, ПАК можно рассмотреть у таких пациентов, если есть снижение
толерантности к физической нагрузке или патологический гемодинамический ответ
на нагрузку, например, увеличение
давления заклинивания легочной артерии больше 25 мм рт. ст. при нагрузке.
В некоторых подгруппах пациентов
развивается систолическая дисфункция ЛЖ с меньшей дилатацией ЛЖ, чем
наблюдаемая у большинства пациентов с неосложненной АР. Они включают
1) пациентов с
длительной гипертензией, у которых снижена податливость перегруженного
давлением желудочка и ограничен потенциал увеличения размера полости; 2)
пациентов с сопутствующей ИБС, у которых ишемия миокарда появляется из-за
повышения пристеночного напряжения миокарда и приводит к дисфункции ЛЖ; 3)
пациентов с сопутствующим МС, у которых левый желудочек не будет расширяться до
такой же степени, как у пациентов с чистой АР (341). У таких пациентов, что особенно важно,
надо следить за фракцией выброса ЛЖ, а не только за систолическим размером. У
женщин также можно проследить появление симптомов и дисфункции ЛЖ с меньшей
дилатаций ЛЖ, чем у мужчин (338). Это, кажется, связано с размером тела, так как
эти различия не столь очевидны, когда размеры ЛЖ приведены к площади
поверхности тела. Следовательно, абсолютные размеры ЛЖ у маленьких пациентов
любого пола могут вводить в заблуждение, и пороговые величины конечного
диастолического и конечного систолического размеров, рекомендованные выше для
ПАК у
бессимптомных пациентов
(75 и 55 мм, соответственно) должны быть уменьшены у таких пациентов. Нет
данных, указывающих на коррекцию размеров ЛЖ в зависимости от размеров тела. В
таких случаях необходимо сопоставление с клиническими данными.
Уменьшение фракции выброса в течение
нагрузочного теста не должно использоваться как единственное показание для ПАК
у бессимптомных пациентов с нормальной систолической функцией ЛЖ в покое,
потому что нагрузочный ответ фракции выброса многофакторен, и сила доказанности
здесь ограничена. Нагрузочный ответ фракции выброса, оказывается, не имеет
независимой прогностической ценности у пациентов, подвергающихся операции (254). Изменения фракции
выброса при нагрузке относительно неспецифичны, связаны с выраженностью
перегрузки объемом
(271,296,300,301) и с серьезностью изменений, индуцированных
нагрузкой, в преднагрузке и
периферическом сопротивлении (280), которые развиваются рано при АР. ПАК не рекомендуется
также бессимптомным пациентам с нормальной систолической функцией и дилатацией
ЛЖ пока дилатация не выраженная (конечный диастолический размер меньше 75 мм
или конечный систолический размер меньше 55 мм).
Пациенты, у которых прогрессирует
дилатация ЛЖ или снижается фракция выброса
при исследовании в динамике,
составляют группу более высокого риска и требуют тщательного контроля
(271), но такие пациенты
часто стабилизируются на продолжительное время. Следовательно, ПАК не
рекомендуется при пороговых величинах, отмеченных выше, при появлении симптомов
или систолической дисфункции ЛЖ.
Однако, незамедлительное направление на
ПАК пациентов с только что появившимися симптомами, сниженной фракции выброса
или прогрессирующей дилатации ЛЖ
приводят к значительно лучшему послеоперационному выживанию, чем если бы
ПАК был (-а) отсрочена до явных
симптомов или более тяжелой
систолической функции (254 265 267).
Хирургические возможности для лечения АР
расширяются с усовершенствованием аортальных гомотрансплантантов, легочных
аутотрансплантатов, биопротезирования, аортальной вальвулопластики. Если эти
методы, в конечном счете, приведут к
улучшению долгосрочного выживания или уменьшат послеоперационные осложнения,
надо думать, что пороговые величины для
рекомендации ПАК могут быть уменьшены. Пока такие данные не получены,
показания для операции при АР должны согласовываться с действующей оперативной
техникой.
3.2.4. Сопутствующая
патология корня аорты
Помимо острой АР,
патология проксимальной аорты может приводить к хронической АР. Дилатация
восходящей аорты является одной из самых частых причин изолированная АР (342). У таких пациентов
клапанная регургитация может быть менее важной для определения тактики лечения,
чем
первичная болезнь аорты,
типа синдрома Марфана, расслоения или хронической дилатации корня аорты,
связанными с гипертензией или двустворчатым аортальным клапаном (см. Раздел
3.3). У
таких пациентов, если АР
легкая, или левый желудочек только незначительно расширен, акцент в лечении делается на основной
болезни корня аорты. У многих пациентов, однако, АР может быть тяжелой и
связанной с резкой дилатацией ЛЖ или систолической дисфункцией, тогда решения
относительно медикаментозной терапии и выбора времени операции должны учитывать
оба условия. Вообще, ПАК и реконструкция корня аорты показаны пациентам с
патологией корня аорты или проксимальной аорты и АР любой тяжести, когда
степень дилатации аорты или корня аорты достигает или превышает 5.0 см
(эхокардиографически) (343). Однако, некоторые рекомендуют операцию при более низком уровне
дилатации (4.5см) или на основании скорости расширения 0.5 см ежегодно или
больше в хирургических
центрах с достаточным опытом пластики корня аорты и восходящей аорты (344). Дилатация корня аорты и восходящей аорты у
пациентов с двустворчатым аортальным клапаном обсуждены достаточно детально в
Разделе 3.3.
3.2.5. Оценка пациентов
после протезирования аортального клапана
После ПАК тщательно
наблюдение необходимо проводить как в течение раннего так и позднего
послеоперационного периода, чтобы оценить функцию протеза клапана и функцию ЛЖ,
как обсуждено в Разделах 9.3. - 9.3.3. Эхокардиография должна быть выполнена
сразу после операции, чтобы оценить воздействие операции на размеры и функцию
ЛЖ и служить основанием для сравнения с последующими эхокардиографиями. Это
исследование может быть выполнено или перед выпиской из больницы или, что предпочтительнее, при
первом амбулаторном приеме. В пределах первых нескольких недель после операции
есть небольшие изменения систолической функции ЛЖ, и фракция выброса может даже
уменьшиться по сравнению с дооперационными величинами из-за уменьшенной
преднагрузки (345). При этом фракция выброса
может увеличиться за последующие несколько месяцев. Таким образом,
сохраняющаяся или более серьезная систолическая дисфункция в ранний
послеоперационный период после ПАК является слабым предиктором последующего
улучшения функции ЛЖ у пациентов с дооперационной дисфункции ЛЖ. Более лучшим
предиктором последующей систолической функции ЛЖ является уменьшение конечного
диастолического размера ЛЖ, который уменьшается значительно в течение
первой-второй недели после ПАК (240 245 346). Это
превосходный маркер
функционального протезирования клапана, потому что 80 % полной редукции
конечного диастолического размера ЛЖ, наблюдаемой в течение позднего
послеоперационного периода, происходит в течение первых 10 - 14 дней после ПАК (240 245 346). Величина уменьшения
конечного
диастолического размера после операции коррелирует с величиной увеличения
фракции выброса (245).
После первичной послеоперационной
переоценки пациент должен наблюдаться и обследоваться повторно через 6 и 12
месяцев и затем ежегодно при неосложненном клиническом течении. Если
пациент является
бессимптомным, ранняя послеоперационная эхокардиография показывает существенное
уменьшение конечного диастолического
размера ЛЖ, систолическая функция ЛЖ нормальная, то динамическая
послеоперационная эхокардиография после
первичного раннего послеоперационного исследования обычно не показана. Однако,
повторная эхокардиография необходима в любом случае, когда появляется новый
шум, возникают вопросы целостности протеза
клапана или сохранности функции ЛЖ. Пациенты с сохранившейся дилатацией ЛЖ на первичной послеоперационной эхокардиограмме должны
рассматриваться, как любой другой пациент с симптомной или бессимптомной
дисфункцией ЛЖ, включая лечение ингибиторами АПФ и бета-блокаторами. У таких
пациентов необходима повторная эхокардиография через 6 и 12 месяцев для оценки
размеров и систолической функции ЛЖ. Если дисфункция ЛЖ сохраняется вне этого
периода времени, повторная эхокардиография должна выполняться по клиническим
показаниям. Тактика лечения пациентов после ПАК детально обсуждается в Разделе
9.3.
3.2.6. Особенности у
пожилых людей
Огромное большинство
пожилых пациентов с аортальным пороком сердца имеют СУА или сочетание СУА И АР,
а чистая АР встречается не часто (347). Пожилые пациенты с АР вообще чувствуют хуже,
чем молодые пациенты или пациенты средних лет. У пациентов старше 75 лет с
большей вероятностью появляются
симптомы или дисфункция ЛЖ в более
ранних стадиях дилатации ЛЖ. Они имеют более постоянную желудочковую дисфункцию
и симптомы сердечной недостаточности после операции и имеют худшую
послеоперационную выживаемость, чем более молодые. Много таких пациентов имеют
сопутствующую ИБС, которая должна быть учтена при оценке симптомов, дисфункции
ЛЖ и показаний для операции. Поскольку цель терапии улучшение качества жизни, а
затем уже продление жизни, симптомы
являются самыми важными для решения
вопроса о проведении ПАК. Тем не менее, бессимптомные или малосимптомные
пациенты, у которых развивается дисфункция ЛЖ (как определено ранее), должны
быть рассмотрены как кандидаты для ПАК, если риск операции не перевешивает
ожидаемого улучшения отдаленного прогноза.
3.3. Двустворчатый аортальный клапан
с дилатацией восходящей аорты
Класс I
1. Пациентам с диагностированным
двустворчатым аортальным клапаном должна проводиться первичная трансторакальная
эхокардиография для оценки диаметров корня аорты и восходящей аорты.
(Уровень доказанности: B)
2. Магнитная резонансная томография
или компьютерная томография сердца показана пациентам с двустворчатым
аортальным клапаном, когда морфология корня аорты или восходящей аорты не может
быть оценена точно с помощью эхокардиографии. (Уровень доказанности: C)
3. Пациентам с двустворчатым
аортальным клапаном и дилатацией корня или восходящей аорты (диаметр больше 4.0
см *) должна проводиться динамическая оценка размера корня аорты/восходящей
аорты и их морфологии посредством
эхокардиографии, магнитной резонансной томографии или компьтерной томографии
сердца ежегодно. (Уровень
доказанности: C)
4. Операция пластики
корня аорты или протезирования восходящей аорты показана пациентам с
двустворчатым аортальным клапаном, если диаметр корня аорты или восходящей
аорты больше 5.0 cm* или если
скорость увеличения диаметра 0.5 см или
больше ежегодно.
(Уровень доказанности:
C)
5. У пациентов с
двустворчатым клапаном, подвергающихся ПАК из-за тяжелых СУА или АР (см.
Разделы 3.1.7 и 3.2.3.8), пластика корня аорты или протезирование восходящей
аорты показаны, если диаметр корня
аорты или восходящей аорты больше 4.5 см *
(Уровень доказанности:
C)
Класс IIa
1. Бетаадреноблокаторы
могут быть назначены пациентам с двустворчатым клапаном и дилатированным корнем
аорты (диаметр больше 4.0 см *), которые не являются кандидатами на
хирургическую коррекцию и не имеют от умеренной до тяжелой АР. (Уровень
доказанности: С)
2. Магнитная резонансная
томография или компьютерная томография сердца может быть показана у пациентов с
двустворчатым аортальным клапаном, когда дилатация корня аорты
обнаружена
эхокардиографически, чтобы определить количественно тяжесть дилатации
затронутость восходящей аорты. (Уровень доказанности: B)
*необходимо
рассматривать пороговые величины для пациентов маленького роста любого пола.
Возрастает понимание того, что много
пациентов с двустворчатым клапаном аорты имеют сосудистые нарушения
соединительной ткани аорты, которая приводит к потере эластичности (348 349), и, в результате, к
дилатации корня аорты или восходящей аорты, даже в отсутствии гемодинамически
существенных СУА или АР (350–353). Исходя из этого,
дилатация корня аорты или восходящей аорты прогрессируют со временем (354). Эти пациенты имеют
риск расслоения аорты, который связан с
тяжестью дилатации (349,355–357). Рекомендации 36th Bethesda Conference (138)
по занятию спортом у пациентов с двустворчатым
клапаном аорты и связанной с ним дилатацией корня аорты или восходящей аорты
основаны на немногочисленных данных, но с пониманием того, что расслоение аорты
может произойти у части пациентов с диаметром корня аорты или восходящей аорты
меньше 50 мм
(344 356 358).
Терапия бетаадреноблокаторами могла бы быть эффективной для замедления
прогрессии аортальной дилатации, но доступные данные были получены у пациентов
с синдромом Марфана (359), а не у пациентов с
двустворчатым аортальным клапаном.
Эхокардиография остается первичным методом
визуализации для идентификации пациентов с увеличением корня аорты или
восходящей аорты. Во многих случаях эхокардиография, включая чрезпищеводую
эхокардиографию, обеспечивает всю необходимую информацию, требуемую для
принятия решения по лечению и наблюдению. Более точное количественное
определение диаметра корня аорты и
восходящей аорты, так же как полную оценку степени расширения, может быть
достигнуто магнитной резонансной
томографией или компьютерной томографией. Эти методы также
позволяют точно
определить размеры и контуры дуги аорты, нисходящей грудной и брюшной аорты.
Когда полученные данные
трансторакальной эхокардиографии относительно корня аорты и восходящей аорты
согласуются с таковыми при магнитной резонансной томографии или компьютерной
томографии, тогда трансторакальная эхокардиография может использоваться для
ежегодного наблюдения. Измерения корня аорты и восходящей аорты показывают
значительную изменчивость в популяции здоровых людей. С учетом возраста и
площади поверхности тела предлжены формулы регрессии и номограммы (360). Верхний предел 2.1
см/м2 расположен на уровне
аортальных синусов. Дилатация констатируется
при увеличением диаметра выше возрастной нормы, приведенной к
поверхности тела, а аневризма определяется как превышение нормального диаметра
на 50 % (361).
Операция пластики корня аорты или
протезирования восходящей аорты рекомендуется пациентам с очень увеличенными
корнем аорты или восходящей аортой (344 349 357 358). При индивидуальном
подходе к рекомендациям по хирургическому лечению надо предусмотреть возраст
пациента, относительный размер аорты и корня аорты, структуру и функцию
аортального клапана, опыт хирургической бригады. Операции, сохраняющие
аортальный клапан выполнимы у большинства пациентов с дилатацией корня аорты
или восходящей, если у них нет существенной АР или кальциноза аортального клапана (362–364). Пациентам с
двустворчатым клапаном рекомендуется провести индивидуально подобранные
пластику аортальный корень или протезирование восходящей аорты, если диаметр
этих структур превышает 5.0 см. Такая операция должна быть выполнена
хирургической бригадой достаточным опытом проведения этих процедур. Некоторые
рекомендуют величину 2.5 см/м2 или больше как показание для операции (365). Если пациенты с
двустворчатым клапаном с сопутствующим расширением корня аорты подвергается ПАК
из-за тяжелых СУА или АР (Разделы 3.1.7. и 3.2.3.8.), рекомендуется выполнение
пластики корня аорты или протезирование восходящей аорты, если диаметр этих
структур больше чем 4.5 см (366).
3.4. Митральный стеноз
3.4.1. Патофизиология и
анамнез
МС – обструкция пути
притока ЛЖ на уровне МК в результате структурной деформации аппарата МК,
которая препятствует необходимому открытию МК
во время диастолического наполнения левого желудочка. Самая частая
причина МС - ревматический кардит. Изолированный МС определяется у 40% всех пациентов
с ревматическими пороками сердца, а ревматический анамнез присутствует у
приблизительно 60 % пациентов с чистым МС (367 368). Отношение женщин к мужчинам с изолированным МС
- 2:1
(367–369).
Врожденный порок МК встречается редко и наблюдается, главным образом, у
младенцев и детей (370). Причины приобретенной обструкции МК, помимо ревматизма, являются
редкими. Они включают миксому левого предсердия, шаровой тромб клапана,
мукополисахаридоз и резкий кальциноз фиброзного кольца. У пациентов с МС
вследствие ревматизма патологические
процессы вызывают утолщение и кальцификацию створок, сращение комиссур и хорд
или их комбинацию (370 371). Результат – воронкообразный митральный аппарат, у которого
площадь отверстия уменьшена. Сращение хорд облитерирует вторичные отверстия, а
сращение комиссур сужает основное отверстие (370 371).
Нормальная площадь МК – от 4.0 до 5.0 см2.
Уменьшение площади отверстия митрального клапана меньше 2.5 см2
обычно приводит к появлению симптомов (139). При уменьшении площади клапана вследствие
ревматического процесса кровоток из левого предсердия в левый желудочек будет
создавать градиент давления. Этот диастолический трансмитральный градиент
является фундаментальным проявлением МС (372) и приводит к повышению давления в левом предсердии,
что отражается на кровотоке в легочных
венах. Уменьшение податливости легочных вен, что частично является результатом
повышения легочного эндотелин-1, может также внести свой вклад в увеличение
легочного венозного давления (373). Увеличение давления и растяжение легочных вен и капилляров
может привести к отёку легкого, так как
легочное венозное давление превышает онкотическое давление плазмы. У пациентов
с хронической обструкцией МК, тем не менее, даже когда МС тяжелый и легочное
венозное давление очень высокое, отёк легких может не возникать вследствие
заметного уменьшения легочной капиллярной проходимости. Легочные артериолы
реагируют
вазоконстрикцией, гиперплазией интимы и медии, которые приводят к легочной
артериальной гипертензии. Площадь МК больше 1.5 см2 обычно не вызывает симптомы в покое (374). Однако, если есть
увеличение трансмитрального кровотока или уменьшение диастолического периода
наполнения, то происходит повышение давления в левом предсердии и появление
симптомов. По законам гидравлики, в отверстии любого размера трансмитральный
градиент есть функция от квадрата скорости чрезклапанного кровотока и зависит
от периода диастолического наполнения (139). Таким образом, появление первых симптомов
одышки у пациентов с легким МС обычно
ускоряется физической нагрузкой, эмоциональным стрессом, инфекцией,
беременностью или фибрилляцией предсердий с частыми желудочковыми сокращениями (374). По мере увеличения
обструкции снижается толерантность к физической нагрузке.
Вместе с увеличением тяжести стеноза
сердечный выброс в покое снижается ниже нормы (374) и уже не увиличивается при физической
нагрузке (375). Степень легочной гипертензии также является
важной причиной симптомов у пациентов с МС (373,374,376). Следующей преградой для кровотока представляется увеличенное
легочное артерииолярное сопротивление (376 377), которое защищает легкие от отёка (376 377). У некоторых
пациентов обратимая преграда
дополнительно развивается на
уровне легочных вен (378 379). Сниженный сердечный
выброс и увеличенное легочное артериолярное сопротивление, которое приводит к
функциональным и структурным изменениям
(утолщение базальной мембраны альвеол, адаптация нейрорецепторов,
увеличение лимфатического дренажа и
увеличение транспульмонального эндотелина), вносят свой вклад в способность
пациента с тяжелым МС оставаться минимально симптомным длительное время (374 376 377).
Особенности анамнеза пациентов с
нелеченным МС были установлены в исследованиях 1950-60 гг. (367– 369). Митральный стеноз - непрерывное, прогрессирующее, пожизненное заболевание,
обычно состоящее из медленно прогрессирующего, стабильного периода в ранние
годы и быстро прогрессирующее позже (367–369,380). В развитых странах ранний продолжительный латентный
период продолжается 20 -
40 лет от возникновения ревматизма до появления симптомов. От появления
симптомов проходит около 10 лет до выраженных признаков инвалидизации (367). В целом, 10-летняя
выживаемость нелеченных пациентов с МС составляет от 50 % до 60 % в
зависимости от выраженности
симптомов
(368, 369).
У бессимптомных или малосимптомных пациентов выживаемость больше 80 % за 10 лет
и 60 % у пациентов без прогрессирования симптомов (368, 369, 380). Однако, если
появляются значительные огрничивающие жизнедеятельность симптомы, 10-летняя
выживаемость составляет 0 % - 15% (367-369 380 381). При возникновении
тяжелой легочной гипертензии средняя выживаемость снижается до 3 лет и меньше (382). Смерть нелеченых
пациентов с МС происходит из-за прогрессирующей легочной и системной недостаточности
в 60 % - 70 %, системной эмболии в 20 % - 30 %, легочной эмболии в 10 % и
инфекции в 1 % - 5 % (369,370). В Северной Америке и
Европе вместо этого классического анамнеза более умеренный и длительный мягкий
период с редкими ревмоатаками (380,383). Средний возраст манифестации симптомов
приходится теперь на пятое-шестое десятилетие (380 383); больше чем одна треть
пациентов подвергаются вальвулолотомии в возрасте старше чем 65 лет (384). В некоторых географических областях МС
прогрессирует более быстро, по-видимому, или из-за более серьезного
ревматического повреждения или из-за повторных эпизодов ревматического кардита
вследствие новой стрептококковой инфекции, в итоге приводя к тяжелому
симптомному МС в позднем
подростковом возрасте и
в начале 3 десятилети\ жизни (380). Исследование гемодинамики в динамике и
допплерэхокардиография показывают ежегодное уменьшение площади МК на 0.09-0.32
см2 (385, 386).
МС описан как болезнь хроническая и
непрерывная, и нет какого-то
единственного показателя, который определял бы тяжесть заболевания. В настоящих руководящих принципах тяжесть МС определяется на
основании колебаний гемодинамики и данных анамнеза (Таблица 4) (27). Для определения
тяжести МС используется средний градиент, систолическое давление в легочной артерии и
площадь клапана следующим образом: незначительный (легкий) (площадь больше 1.5
см2, средний градиент меньше 5 мм рт ст или систолическое давление в
легочной артерии меньше 30 мм рт. ст.), умеренный (площадь 1.0 - 1.5см2 , средний градиента 5 -
10 мм рт.ст. или систолическое давление в легочной артерии 30 - 50 мм рт.ст.) и
тяжелый (площадь меньше 1.0 см2 , средний градиент больше 10 мм
рт.ст. или систолическое давление в легочной артерии больше 50 мм рт.ст.).
3.4.2. Показания для
эхокардиографии при митральном стенозе
Класс I
1. Эхокардиография
должна быть выполнена у пациентов для диагностики МС, оценки гемодинамической
тяжести (средний градиент, площадь МК и давление в легочной артерии), оценки
сопутствующих клапанных повреждений и
оценка морфологии клапана (определить пригодность для чрезкожной баллонной
вальвулопластики). (Уровень доказанности: B)
2. Эхокардиография
должна быть выполнена для переоценки у пациентов с диагностированным МС и
динамикой симптомов. (Уровень доказанности: B)
3. Эхокардиография
должна быть выполнена для оценки доплеровских показателей гемодинмики, в
частности, среднего градиента давления
и давления в легочной артерии, при нагрузочном тесте у пациентов с МС,
когда есть несоответствие между допплерэхокардиографией в состоянии покоя и
клиническими данными. (Уровень доказанности: C)
4. Чрезпищеводная
эхокардиография при МС должна быть выполнена для оценки наличия тромба в левом
предсердии и, далее, для оценки тяжести МР у пациентов, рассматриваемых для
чрезкожной митральной баллонной вальвулотомии. (Уровень доказанности: C)
5. Чрезпищеводная
эхокардиография при МС должна быть выполнена для оценки морфологию и
гемодинамики МК у пациентов, когда трансторакальная эхокардиография
неоптимальна. (Уровень доказанности: C)
Класс IIa
Эхокардиография может
быть выполнена для оценки давления в легочной артерии у бессимптомных пациентов
с МС и стабильными клиническими данными (при тяжелом МС каждый год; умеренный
МС, каждые 1 - 2 года; незначительный
МС каждые 3 - 5 лет).
(Уровень доказанности:
C)
Класс III
Чрезпищеводная
эхокардиография у пациентов с МС не показана для рутинной оценки
морфологии и
гемодинамики МК, когда данные трансторакальной эхокардиографии
удовлетворительные. (Уровень доказанности: C)
Диагноз МС должен выставляться на основе
анамнеза, осмотра, рентгенографии органов грудной клетки и ЭКГ (рис. 5). Пациенты могут не
называть симптомы, но они выявляются при осмотре (380, 383). У одних пациентов при
первичном осмотре определяются усталость, одышка или явный отёк легких, у
других, начальное проявление МС – впервые возникшая фибрилляция предсердий или тромбэмболия (367). Редко павциенты
предстают с кровохарканьем, хрипотой или дисфагией.
Характерные данные
аускультации при ревматическом МС:
усиленный первый тон сердца (S1), щелчок открытия (OS), низкочастотный
среднедиастолический шуми пресистолический шум. Эти данные, однако, могут также
присутствовать у пациентов с неревматической обструкцией МК (например, миксома
левого предсердия), и, в то же время, могут отсутствовать при тяжелой легочной
гипертензии, низком сердечном выбросепродукция и при резко кальцинированном
неподвижном МК. Более короткий интервал A2-OS и увеличенная
продолжительность диастолического шума указывают на более тяжелый МС. Интервал
A2-OS меньше 0.08 секунд подразумевает тяжелый МС (387). Признаки легочной гипертензии при
осмотре, такие как акцент второго тона или пульсация правого желудочка (ПЖ),
также предполагают тяжелый МС.
Диагностическим исследованием выбора для
оценки пациента с МС является 2D и допплеровская эхокардиография (388–393). Эхокардиография в состоянии идентифицировать
ограничение диастолического открытия створок МК как “куполоподобную ” переднюю
створку и неподвижную заднюю створку (388,390,392,393). Другие состояния, которые могут симулировать
клинику ревматического МС, такие как
миксома левого предсердия, мукополисахаридоз, неревматический склеротический
МС, трехпредсердное сердце и парашютный МК могут быть достоверно
идентифицированы 2D эхокардиографией. Определение площади отверстия
возможно в позиции короткой оси. Двумерная эхокардиография может использоваться
для оценки морфологических особенностей аппарата МК, включая подвижность и гибкость створок, толщину створок,
кальцификацию створок, подстворчатое сращение и состояние комиссур (391,394–398). Эти особенности могут быть важными, когда
конкретно рассматривается время и тип вмешательства
(394–400). Пациенты с подвижными некальцифицированными
створками, без кальцифицированных комиссур и небольшим подстворчатым сращением
могут быть кандидатами на баллонную катетеризацию или на хирургическую
комиссуротомию/вальвулотомию (394–399). Для оценки пригодности к вальвулотомии используются
градация Wilkins (Таблица 17) (400), эхокардиографическое распределение по группам
(основанное на подвижности клапана, подстворчатом сращении и кальцификации
створок)
(397) и
наличие кальция в комиссурах (398). Двумерное эхокардиографическое исследование позволяет
также оценить размеры и функцию полостей сердца и другие структурные отклонения
створок, миокарда или перикарда.
Таблица 17. Определяющие факторы эхокардиографической оценки митрального
клапана
Степень Подвижность Подклапанное утолщение Утолщение Кальцификация
1 Ограничена подвижность
только Минимальное утолщение хорд Створки почти нормальной Единичный участок
кончиков створок только под
митральными створками толщины (4-5 мм) высокой эхо-яркости
2 Середина и основание
створок Утолщение хордальных
структур В средней части хорды Рассеянные участки
имеют нормальную
подвижность распространяется на одну
треть нормальные,
значительное яркости, ограниченные
длины хорды краевое утолщение (5-8
мм) краями створок
3 Клапан продолжает двигаться Утолщение распространяется на Утолщение на протяжении Яркость распространяется
вперед в диастолу, в основном дистальную треть хорд всей длины створок
(5-8 мм) на среднюю часть створок
за счет основаноя
4 Нет совсем или
минимальное Распространение
утолщения и Резкое утолщение
створок Распространение яркости
движение вперед створок в укорочения всех хордальных на всем протяжении по большей части створок
диастолу
структур до папиллярных мышц
(8-10 мм)
Перепечатано
с разрешения из Wilkins GT, Weyman AE, Abascal VM, Block PC, Palacios IF. Percutaneous balloon
dilatation of the mitral valve: an analysis of
echocardiographic variables related to
outcome and the mechanism of dilatation. Br Heart J 1988;60:299–308 (400).
Допплеровская эхокардиография может
использоваться для оценки гемодинамической тяжести обструкции (389 391 401). Средний
трансмитральный градиент может быть точно и воспроизводимо
измерен
постоянно-волновым допплеровским сигналом через МК по модифицированному уравнению Бернулли (391,401). Площадь МК может быть неинвазивно измерена доплеровской эхокардиографией при любом
диастолическом давлении методом полупериода (401–404) или уравнения непрерывности (402). Метод полупериода может быть неточным у пациентов
с изменениями левого предсердия или податливости ЛЖ, у пациентов с
сопутствующей АР и у пациентов после митральной вальвулотомии (403,404). Допплерэхокардиография может также
использоваться для оценки систолического давления в легочной артерии по скорости
сигнала ТР (405) и для оценки сопутствующих МР и АР. Основные гемодинамические
показатели при нагрузочном тесте могут быть определены неинвазивно с помощью
регистрации трансмитральной и трикуспидальной
допплеровских скоростей при велоэргометрии лежа на спине или с
вертикальным тредмилом (406–409). Это позволяет измерять оба трансмитральных градиента (407–409) и систолическое
давление в легочной артерии (406, 408) в покое и при нагрузке (410). Критерии для оценки тяжести МС суммированы в Таблице 4 (27). Эти критерии
применимы, когда частота сердечных сокращений от 60 до 90 в 1 мин.
У всех пациентов с МС при выявлении
заболевания должны быть проведены осмотр, ЭКГ и рентгенография грудной клетки.
2D и допплерэхокардиография также должны быть проведены для
подтверждения МС и исключения другой причины обструкции МК
и сопутствующих заболеваний миокарда или других пороков сердца. Должны быть
оценены морфология аппарата МК и показания
для вальвулотомии. Для оценки
тяжести МС используются оба средних трансмитральных
градиента и площадь
клапана, определенные допплерэхокардаиографически; также, когда это возможно,
должно быть оценено давление в легочной артерии. Чрезпищеводная эхокардиография
показана, если есть сомнения в дмиагнозе после трансторакальной
эхокардиографии.
У бессимптомных пациентов, у которых установлен незначительный МС
(площадь клапана больше 1.5 см2
и средний градиент меньше 5 мм рт.ст.), в дальнейших исследованиях на начальном
этапе нет необходимости (рис. 5). Эти пациенты обычно
остаются стабильными в течение многих лет (368, 369, 380). Если есть более значимый МС, тактика
дальнейшего наблюдения должна быть основана на пригодности пациента для
митральной вальвулотомии. У пациентов с гибкими некальцифицированными
клапанами, без (или незначительно выраженный) подстворчатого сращения, без кальцификатов в комиссурах и
без тромба в левом предсердии чрезкожная митральная вальвулотомия может быть
выполнена с низкой частотой осложнений или может быть показана при
прогрессировании симптомов. При медленно прогрессирующем течении МС пациенты
могут оставаться "бессимптомными" с тяжелым стенозом всего-лишь за
счет коррекции их образа жизни к менее подвижному (сидячему) уровню. Повышенное
легочное сосудистое сопротивление и/или низкий сердечный выброс могут также
играть адаптивную роль в предупреждении застойных симптомов у пациентов с тяжелым МС (374, 376, 377). Повышение легочного
сосудистого сопротивления является
важным физиологическим событием при МС (377), и уровень легочного давления –
индикатор состояния гемодинамики. Пациентам с умеренной легочной гипертензией в
покое (систолическое давление в легочной артерии больше 50 мм рт.ст.) и гибкими
створками МК показана чрезкожная митральная вальвулотомия, даже если они
отрицают симптомы. Пациентам, которые ведут
малоподвижный образ
жизни, показан гемодинамический нагрузочный тест с допплерэхокардиографией (406–409). Объективное
ограничение толерантности к физической нагрузке с повышением трансмитрального
градиента больше 15 мм рт.ст. и повышение систолического давления в легочной
артерии больше 60 мм рт.ст. может быть показанием для чрезкожной вальвулотомии,
если морфология МК является подходящей. Выделена подгруппа бессимптомных
пациентов с тяжелым МС (площадь клапана меньше 1.0 см2) и резкой
легочной гипертензией (систолическое давление в легочной артерии больше 75 %
системного давления в покое или при нагрузке). Если у этих пациентов морфологии
клапана не благоприятна для чрезкожной митральной баллонной вальвулотомии или
операции протезирования клапана, замена клапана для предовращения
недостаточности ПЖ является спорной, но операция вообще рекомендуется таким
пациентам. Однако, пациент (и семья) должны быть вовлечены в решение
относительно вмешательства.
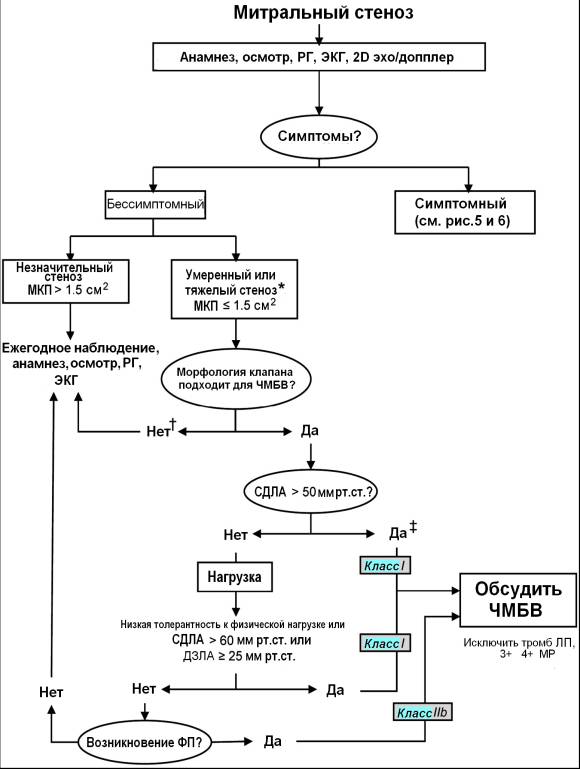
Рис 5
3.4.3. Медикаментозная
терапия
3.4.3.1. Медикаментозная
терапия:общая
У пациентов с МС главной
проблемой является механическая обструкция кровотоку на уровне МК, и медикаментозная терапия не может заметно
уменьшить фиксированную обструкцию. Левый
желудочек защищен от перегрузки давлением или объемом, и таким образом,
какая-то специфическая медикаментозная терапия не требуется у бессимптомного
пациента с незначительным МС и нормальным синусовым ритмом. Поскольку ревматизм
является самой частой причиной МС, рекомендуется профилактика ревматизма.
Инфекционный эндокардит встречается редко, но может осложнить изолированный МС (368, 369), и соответствующая
профилактика эндокардита также рекомендуется.
Пациенты, которые имеет более чем
незначительную степень МС, должны избегать необычных физических нагрузок.
Увеличенный кровоток и укороченный период диастолического наполнения вследствие
тахикардии увеличивают давление в левом предсердии, которое уже увеличено из-за
обструкции МК. Препараты с негативным хронотропным эффектом, типа
бета-блокаторов или некоторых блокаторов кальциевых каналов, могут быть полезны
у пациентов с синусовым ритмом, которые имеют симптомы, вызванные физической
нагрузкой, если эти симптомы возникают с высокой частотой сердечных сокращений (411, 412). Собщают о большей
эффективности бета-блокаторов по сравнению с регулирующими ЧСС блокаторами
кальциевых каналов (413). Некоторые пациенты с МС
имели повышенную бронхиальную реактивность, которая улучшалась после ингаляции
кортикостероидов (414). Ограничение соли и
непостоянный прием диуретиков показаны, если есть признаки легочного
сосудистого застоя. Сердечные гликозиды не показаны пациентам с МС и с
синусовым ритмом, если дисфункция ЛЖ или ПЖ (415).
Хотя МС является медленно прогрессирующим
заболеванием, острый отёк легких может внезапно возникнуть у бессимптомных
пациентов с тяжелым МС, особенно с впервые возникшей тахисистолической
фибрилляцией предсердий, и это может
быть фатальным. Таким образом,
пациентам надо
рекомендовать немедленно обращаться за медицинской помощью, если они испытывают
внезапное увеличение одышки.
3.4.3.2. Медикаментозная
терапия: фибрилляция предсердий
Пациенты с МС склонны к
возникновению предсердных аритмий, особенно фибрилляции предсердий и трепетания
предсердий. У 30-40% пациентов с симптомным МС развивается фибрилляция
предсердий
(367, 368).
Структурные изменения в результате перегрузки давлением и объемом изменяют
электрофизиологические свойства левого предсердия (380), и ревматический процесс сам по себе может
привести к фиброзу межузлового и межпредсердного трактов и повреждению
синоатриального узла. Острое появление фибрилляции предсердий и, прежде всего, высокая ЧСС, которая сокращает
период диастолического наполнения и вызывает повышение давления в левом
предсердии, приводит к значительным гемодинамическим последствиям. Фибрилляция
предсердий возникает чаще всего у пожилых пациентов (367) и ассоциируется с более плохим прогнозом,
10-летнее выживание 25 % по сравнению с 46 % у пациентов с синусовым ритмом (369). Риск артериальной
тромбэмболии, особенно инсульта, значительно увеличен у пациентов с
фибрилляцией предсердий (367,368,416–418).
Лечение острого эпизода пароксизмальной
фибрилляции предсердий включает антикоагулянтную терапию гепарином и контроль ЧСС. Для контроля частоты желудочковых сокращений должны
использоваться дигоксин внутривенно, регулирующие ЧСС блокаторы кальциевых
каналов или бета-блокаторы, которые
замедляют проводимость через атриовентрикулярный узел. В тех случаях, когда бета-блокаторы
или блокаторы кальциевых каналов не могут использоваться, можно применять
амиодарон внутривенно или внутрь. Если гемодинамика нестабильна, должна быть
срочно проведена электрическая
кардиоверсия с внутривенным введением гепарина
до, в течение, и после процедуры. У некоторых пациентов может быть
проведена химическая кардиверсия. Пациенты, у которых фибрилляция предсердий
продолжается более 24 - 48 часов без антикоагуляции, имеют повышенный риск тромбоэмболических осложнений после
кардиверсии, но тромбоэмболия может произойти и
меньше чем за 24 часа
фибрилляции предсердий. Решение проводить кардиверсию у конкретного пациента
зависит от многих факторов, включая продолжительность фибрилляции предсердий,
гемодинамический ответ на возникновение фибрилляции предсердий,
документированный анамнез
предшествующих эпизодов
фибрилляции предсердий и анамнез имевшихся тромбоэмболических осложнений. Если
принято решение провести кардиоверсию у пациента, который имел
документированную фибрилляцию предсердий больше чем 24 - 48 часов и не получал
длительную антикоагуляцию, рекомендуется 1 из 2 подходов, основанных на данных,
полученных у пациентов с
неревматической фибрилляцией предсердий.
Первый – антикоагуляция варфарином в течение более 3 недель с проведением
кардиверсии
(419).
Второй – антикоагуляция гепарином и наблюдение за тромбом в левом предсердии с
помощью чрезпищеводной эхокардиографиией. При отсутствии тромба левого
предсердия кардиоверсия проводится с внутривенным введением гепарина до, в
течение и после процедуры (420). Важно продолжать длительную антикоагуляцию
после кардиоверсии.
Для поддержания синусового ритма у части
пациентов с возвратной пароксизмальной фибрилляцией предсердий можно
рассматривать антиаритмические препараты класса IC (в сочетании с
препаратами с отрицательным дромотропным эффектом) или класса III; однако,
в конечном счете,
фибрилляция предсердий становится устойчивой к лечению или кардиверсии (376), и контроль частоты
желудочковых сокращений становится основной терапией. Дигоксин замедляет ЧСС у
пациентов с фибрилляцией предсердий и МС (415). Однако, регулируюшие ЧСС блокаторы кальциевых
каналов или бета-блокаторы более эффективны для предотвращения увеличения ЧСС,
индуцированного физической нагрузкой.
Пациентам, как с пароксизмальной, так и с постоянной формой фибрилляции
предсердий нужно рекомендовать длительную антикоагуляцию варфарином для
предотвращения тромбоэмболических осложнений, если они не имеют серъезных
противопоказаний для антикоагуляции (417, 421). Спорный вопрос, показана ли чрезкожная
митральная вальвулотомия пациентам с вновь возникшей фибрилляцией предсердий и
с МС от умеренного до тяжелого, в остальном бессимптомными.
Успешная чрезкожная баллонная митральная
комиссуротомия, возможно, не предотвращает
развитие фибрилляции предсердий.
Пожилой возраст и размер левого предсердия, похоже,
важные предикторы
развития фибрилляции (422).
3.4.3.3. Медикаментозная
терапия: предотвращение системной эмболии
Класс I
1. Антикоагуляция
показана пациентам с МС и фибрилляцией предсердий (парксизмальной,
рецидивирующей или постоянной). (Уровень доказанности: B)
2. Антикоагуляция
показана пациентам с МС и тромбэмболией в анамнезе, даже с синусовым ритмом.
(Уровень доказанности: B)
3. Антикоагуляция
показана пациентам с МС с тромбом в левом предсердии. (Уровень доказанности:
B)
Класс IIb
1. Антикоагуляция может
быть рассмотрена у бессимптомных пациентов с тяжелым МС и эхокардиографическим
размером левого предсердия большим или равным 55 мм.*
(Уровень доказанности:
B)
2. Антикоагуляция может
быть рассмотрена у пациентов с тяжелым
МС, увеличенным левым предсердием и спонтанным
контрастированием на эхокардиографии. (Уровень доказанности: C)
*Эта рекомендация
основана на
степени C уровня
доказанности,
данной American College of Chest
Physicians Fourth Consensus Conference on
Antithrombotic Therapy (423).
Системная тромбэмболия может произойти у 10%-20%
пациентов с МС (367 368 416). Риск тромбэмболии связан с возрастом и наличием
фибрилляции предсердий (367,368,416–418). Одна треть случаев тромбэмболии происходит в течение 1 месяца
после начала фибрилляции предсердий, и
две трети происходят в пределах одного года. Частота случаев тромбоэмболии,
похоже, не связана с тяжестью МС, сердечным выбросом, размером левого
предсердия или, даже с присутствием или
отсутствием симптомов
сердечной недостаточности (368 417 424). Случай тромбэмболии может, таким образом, быть начальным
проявлением МС (367). У пациентов, у которых был эпизод тромбоэмболии,
частота повторных эпизодов составляет 15 - 40 случаев на 100 пациент-месяцев (417–421).
Не проводилось рандомизированных
испытаний, которые бы исследовали эффективность
антикоагуляции в
предупреждении тромбоэмболии именно у пациентов с МС. Ретроспективные исследования показали 4-15-кратное уменьшение
случаев тромбэмболий при антикоагуляции у этих пациентов (417, 421). Эти результаты
относятся как к системной, так и к легочной эмболии. Большинство исследований
включали пациентов, которые имели 1 тромбэмболию перед началом
антикоагуляционной
терапии
(421).
Однако, большие рандомизированные исследования продемонстрировали значительное
уменьшение сучаев тромбэмболии при лечении антикоагулянтами у пациентов с фибрилляцией предсердий, не
связанной с МС (425,426). В этих рандомизированных
исследованиях пациентами, имевшие наилучший результат от антикоагуляции, были
пациенты с
самым высоким риском
тромбэмболии
(353, 354).
Пациенты с МС с самым высоким риском
тромбэмболий в будущем – это пациенты с предыдущими тромбэмболиями и пациенты с
пароксизмальной или постоянной фибрилляцией предсердий (367,368,416–418,421). Пароксизмальную
фибрилляцию предсердий не всегда легко обнаружить; амбулаторное мониторирование
ЭКГ может быть весьма полезным у пациентов с сердцебиениями. Пока нет данных о
полезности пероральной антикоагуляции у пациентов с МС, у которых не было
фибрилляции предсердий или
тромбэмболии. Нет единого мнения, что пациенты без фибрилляции предсердий или
эпизода тромбоэмболии, которые имеют более высокий риск будущей тромбэмболии
(то есть, с тяжелым МС или с увеличенным левым предсердием), нуждаются в
длительной терапии варфарином
(423,427).
Несмотря на то, что тромбоэмболия, как
думают, возникает из тромба левого предсердия (417, 418), наличие или отсутствие
тромба левого предсердия, похоже, не коррелирует со случаями тромбэмболии (367, 418). Тромб левого
предсердия обнаружен во время операции у 15%-20% пациентов с предшествующей
тромбэмболией и у такого же числа пациентов без тромбэмболии (367, 416). Однако, в клинической
практике антикоагуляция часто используется, если достоверно обнаружен тромб
левого предсердия.
Предполагается, что хирургическая
комиссуротомия уменьшает вероятность будущей тромбэмболии (381). Нет рандомизированных
исследований, подтверждающих эту гипотезу, а
ретроспективные
исследования, о которых сообщалось, были выполнены до применения
стандартизированных режимов антикоагуляции.
Другие ретроспективные исследования констатируют, что операция не
уменьшает вероятность системной эмболии (380, 428, 429). Одно проспективное исследование
сообщает об уменьшении риска артериальной эмболии после митральной комиссуротомии (430).
3.4.4. Рекомендации по
физической активности и нагрузке
Многие пациенты с незнасительным (легким)
МС остаются бессимптомными даже при значительной нагрузке. При более тяжелом МС
физическая нагрузка может вызывать внезапное заметное увеличение легочного
венозного давления вследствие повышения ЧСС и сердечного выброса, иногда приводя к отёку легких (375, 376). Эффекты длительного, связанного с повторными
физическими нагрузками, увеличения легочного венозного давления и легочного
артериального давления на легкие или правый желудочек пока неизвестны. МС редко
вызывает внезапную смерть (367–369). Эти факторы надо рассматривать, рекомендуя физическую активность
и упражнения
пациентам с МС.
У большинства пациентов с МС имеющиеся
симптомы ограничивают рекомендации по физической нагрузке. Пациентам необходимо
советовать низкоуровневую аэробную тренировочную программу для сохранения
работоспособности сердечно-сосудистой системы. Одышка, вызванная физической
нагрузкой, является ограничивающим фактором в понятии толерантности к
физической нагрузке. Однако, есть группа бессимптомных пациентов, которые хотят
участвовать в спортивных соревнованиях и могут отрицать симптомы. The 36th Bethesda Conference on Recommendations for Determining Eligibility for Competition in Athletes with Cardiovascular Abnormalities издала
руководство
для
пациентов
с
МС, которые
желают
участвовать
в
спортивных
соревнованиях
(138).
3.4.5. Тестирование в
динамике
Наблюдение и
исследование в динамике пациента с МС основаны на том, насколько результаты
теста скажутся на изменениях в терапии или на рекомендациях какой-либо
процедуры. До появления симптомов у пациентов с МС обычно проходят годы (367, 380). Всех пациентов
необхоимо информировать, что любое изменение в симптомах требует
переоценки. Бессимптомным пациентам
рекомендуется ежегодная переоценка (рис. 5). При ежегодном обследовании должны быть
проведены осмотр, рентгенография органов грудной клетки, ЭКГ и собран анамнез.
Осмотр позволяет оценить прогрессирование тяжести МС. Укорочение интервала A2-OS,
увеличение продолжительности среднедиастоличекого шума и наличие признаков
легочной гипертензии указывают на более тяжелый МС. Эхокардиограмма не
рекомендуется ежегодно, если нет изменений в клиническом состоянии и если нет
тяжелого МС. Пациентам с сердцебиениями
показано амбулаторное мониторирование ЭКГ (Holter или event
регистратор) для выявления пароксизмальной
фибрилляции предсердий.
3.4.6. Оценка
симптомного пациента
Пациенты, у которых
появляются симптомы, должны пройти обследование, включающее анамнез, осмотр,
ЭКГ, рентгенография органов грудной клетки и эхокардиография (Рис. 6 и 7). Двумерная эокардиография и
допплерэхокардиография показана для оценки морфологии МК, гемодинамики МК и
давления в легочной артерии. Пациенты с умеренным или тяжелым МС и с симптомами
II функционального класса по NYHA (площадь МК меньше или равная 1.5 см2
или средний градиент больше 5 мм рт.ст.)
могут быть рассмотрены для митральной баллонной вальвулотомии, если у
них подходящая морфология МК и нет тромба левого предсердия. У пациентов с
тяжелым МС и с симптомами III или IV функционального класса по NYHA
плохой прогноз, если не проводить лечение (367–369), и их нужно рассмотреть для вмешательства в виде или баллонной
вальвулотомии или операции.
Выделяется группа пациентов, у которых
есть значительные ограничивающие симптомы, и при этом клиническая и допплерэхокардиографическая оценка не указывают на
умеренный или тяжелый МС. У таких
пациентов показаны формализованная нагрузочная проба или добутаминовая
стресс-проба для
Дифференциальной
диагностики МС от других причин симптомов. Толерантность к физической нагрузке,
ЧСС, АД, трансмитральный градиент и давление в легочной артерии должны быть
оценены в покое и в течение нагрузки. Это обычно достигается или с помощью
велоэргометроии лежа на спине или с вертикальным нагрузочным тестированием с
допплеровской регистрацией ТР и трансмитральной скорости (406–409). Право- и лево-сердечная катетеризация с нагрузкой
может быть полезна, а иногда и необходима (431). Симптомные пациенты со значительным повышением
давления в легочной артерии (больше 60 мм рт.ст.), среднего трансмитрального
градиента (больше 15 мм рт.ст.) или
давления заклинивания легочной артерии (больше 25 мм рт.ст.) в течение
нагрузки (375,407–409, 432, 433) имеют гемодинамически
значимый МС и должны быть рассмотрены для дальнейшего вмешательства.
Альтернативно, пациенты, которые не продемонстрировали повышение значений
указанных показателей, совпадающих с развитием симптомов, вызванных нагрузкой,
наиболее вероятно не извлекут выгоду из вмешательства на МК.
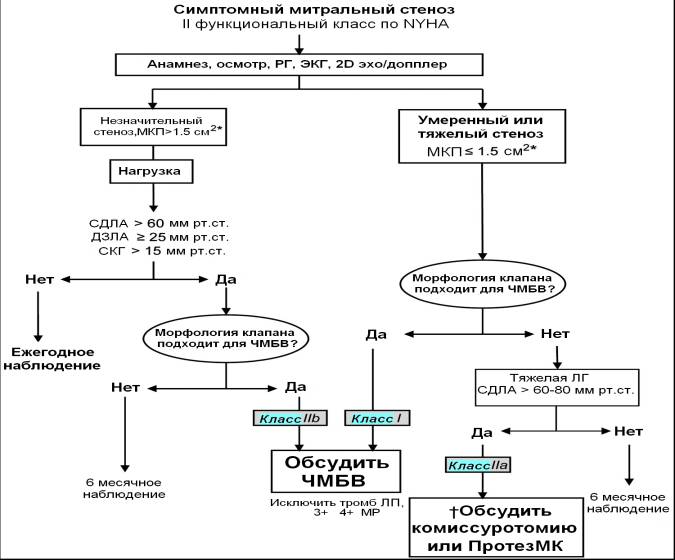
Рис 6.
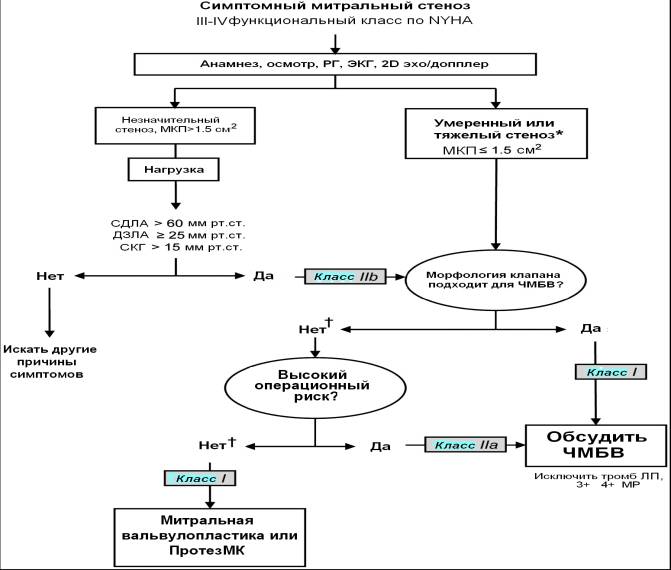
Рис 7.
3.4.7. Показания для
инвазивной оценки гемодинамики
Класс I
1. Зондирование сердца
для гемодинамической оценки должно быть выполнено для оценки тяжести МС, когда неинвазивные тесты являются
неокончательными или когда
есть несоответствие
между неинвазивными тестами и клиническими данными относительно тяжести МС.
(Уровень доказанности: C)
2. Зондирование для
гемодинамической оценки, включая
вентрикулографию (оценка тяжести МС) пациентов с МС показано, когда есть
несоответствие между измеренным допплерэхокардиографией средним градиентом и
площадью клапана. (Уровень доказанности: C)
Класс IIa
1. Зондирование сердца
может быть показано для оценки гемодинамического ответа давления в легочной
артерии и давления в левом предсердии
при нагрузке, когда клинические
симптомы и гемодинамика в покое противоречат друг другу. (Уровень
доказанности: C)
2. Зондирование сердца
может быть показано пациентам с МС для оценки причины тяжелой легочной
артериальной гипертензии, когда она не соответствует тяжести МС по результатам
неинвазивных исследований. (Уровень доказанности: C)
Класс III
Диагностическое
зондирование сердца не рекомендуется для оценки гемодинамики МК, когда 2D и допплерэхокардиография согласуются с клиническими данными.
(Уровень доказанности: C)
Измерение показателей гемодинамики с помощью зондирования сердца может
использоваться для определения тяжести МС. Точное измерение левого предсердия и
давления ЛЖ определяют трансмитральный градиент, который является
фундаментальным отражением тяжести МС (372). Поскольку тяжесть обструкции зависит от
кровотока и градиента (376), гидравлическое уравнение Gorlin используется в лаборатории зондирования для вычисления
площади клапана (139). Давление в легочной артерии и легочное сосудистое сопротивление
должны быть измерены для определения
воздействия МС на
легочное кровообращение.
С появлением допплерэхокардиографии
зондирование сердца больше не требуется для оценки
гемодинамики у
большинства пациентов с изолированным МС. Достаточно точные величины
трансмитрального градиента могут быть получены с помощью модифицированного
уравнения Бернулли (389 391). Возможные проблемы, связанные с углом зондирования, давлением
восстановления, проксимальным ускорением и неадекватной скоростью сигналов, которые
возникают при других клапанных повреждениях, не актуальны при МС. Часто
присутствует переоценка трансмитрального градиента, когда катетеризация
выполнена с измерением давления заклинивания легочной артерии вместо давления в
левом предсердии, даже после коррекции
на задержку фазы. Таким образом, трансмитральный градиентl,
определенный допплерэхокардиографией, может быть более точным чем полученный
зондированием сердца с помощью давления заклинивания легочной артерии (434).
Площадь МК определяется или методом
полупериода или уравнением непрерывности допплерэхокардиографией. Эти измерения
площади клапана коррелируют хорошо в большинстве случаев с измерениями при
зондировании сердца (401, 402). Доплеровский метод полупериода может быть неточным, если есть
изменения податливости левого предсердия или левого желудочка (402,403), особенно после
митральной баллонной вальвутомии, или если есть сопутствующая АР. Есть
ограничения в вычислении площади МК по данным катетеризации сердца, поскольку
уравнение Gorlin, возможно, невалидно при измененной
гемодинамике, и эмпирический свободный коэффициент может быть неточным при
различных формах отверстия (379, 404). Вычисление площади клапана при катетеризации
также зависит от измерения трансмитрального градиента и сердечного выброса.
Градиенты могут быть
неточными, когда используется давление заклинивания легочной артерии, так же
как сердечный выброс, полученный методом термодилюции. Когда есть сопутствующая
МР, измерение потока методом термодилюции или методом Фика приведет к
недооценке площади МК, как обсуждено в Разделе 3.7.2.2.2. Таким образом, могут
быть погрешности с измерением площади
клапана как допплерэхокардиографически,
так и при катетеризации сердца, и единичное измерение площади клапана не может быть единственной мерой
тяжести МС. Оценка тяжести МС должна быть основана на всех данных, включая
трансмитральный градиент, площадь МК, давление заклинивания легочной артерии и
давление в легочной артерии.
В большинстве случаев
допплерэхокардиографические измерения трансмитрального градиента,
площади клапана и давления в легочной артерии хорошо коррелируют друг с другом.
Катетеризация сердца показана для оценки гемодинамики, когда есть
несоответствие между определенными допплерэхокардиографически гемодинамическими
показателями и клиническим состоянием у
симптомного пациента. Абсолютные
лево- и правосторонние измерения давления должны быть проведены с помощью
катетеризации, если есть повышение давления в легочной артерии не
пропорциональное среднему градиенту и площади клапана. Инвазивная оценка
гемодинамики также необходима для оценки тяжести и гемодинамической причины
увеличения легочного сосудистого
сопротивления, потому что легочная
вазодилататорная терапия может быть полезна у таких пациентов. Зондирование сердца, включая левожелудочковую
вентрикулографию (для оценки тяжести МР) показана, когда есть несоответствие
между допплерографически вычисленными средним градиентом и площадью клапана.
Ангиография корня аорты может быть необходима для оценки тяжести АР. Если
симптомы не соответствуют неинвазивной оценке гмодинамики в покое, может быть
полезна право- и лево-сердечная катетеризация с нагрузкой. Если есть сомнение
относительно
точности давления заклинивания
легочной артерии, редко используется транссептальная катетеризация для прямого
измерения давления в левом предсердии. Коронароангиография может проводиться у
отдельных пациентов, которые, возможно,
нуждаются во вмешательстве (см. Раздел 10.2.).
3.4.8. Показания для чрезкожной
митральной баллонной вальвулотомии
Класс I
1. Чрезкожная баллонная митральная
вальвулотомия эффектива у симптомных пациентов (функциональный класс II, III
или IV по NYHA) с умеренным или тяжелым МС* и морфологией клапана
благоприятной для чрезкожной митральной баллонной вальвулотомии при отсутствии
тромба левого предсердия или от умеренной к тяжелой МР. (Уровень
доказанности: A)
2. Чрезкожная баллонная митральная
вальвулотомия эффектива у бессимптомных пациентов с умеренным или тяжелым МС* и морфологией клапана благоприятной
для чрезкожной митральной баллонной вальвулотомии, у которых есть легочная
гипертензия (систолическое давление в легочной артерии больше 50 мм рт.ст. в
покое или больше 60 мм рт.ст. при нагузке) при отсутствии тромба левого
предсердия или от умеренной к тяжелой МР. (Уровень доказанности: C)
Класс IIa
Чрезкожная митральная баллонная
вальвулотомия может быть показана пациентам с умеренным или тяжелым МС* ,
которые имеют негибкий кальцинированный клапан, имеют III–IV функциональный класс по NYHA и либо не являются кандидатами на
операцию, либо имеют высокий операционный риск. (Уровень доказанности: C)
Класс IIb
1. Чрезкожная митральная баллонная
вальвулотомия может быть рассмотрена у бессимптомных пациентов с умеренным или
тяжелым МС* и морфологией клапана благоприятной для чрезкожной митральной
баллонной вальвулотомии, у которых есть впервые возникшая фибрилляция
предсердий без тромба левого предсердия или от умеренной до тяжелой МР.
(Уровень доказанности: C)
2. Чрезкожная митральная баллонная
вальвулотомия может быть рассмотрена у симптомных пациентов (функциональный класс II, III, или IV по NYHA) с площадью МК больше 1.5 см2, если есть признаки
гемодинамически значимого МС:
систолическое давление в легочной артерии
больше 60 мм рт.ст.,
давление заклинивания легочной артерии 25 мм рт.ст. или больше, или средний
градиент МК больше 15 мм рт.ст. в
течение нагрузочной пробы. (Уровень доказанности: C)
3. Чрезкожная митральная баллонная
вальвулотомия может быть рассмотрена как альтернатива
операции для пациентов с умеренным или тяжелым МС, у которых негибкий
кальцинированный клапан и класс III–IV по NYHA. (Уровень
доказанности: C)
Класс III
1. Чрезкожная митральная баллонная
вальвулотомия не показана пациентам с незначительным
МС. (Уровень доказанности: C)
2. Чрезкожная митральная баллонная
вальвулотомия не должна выполняться пациентам с
от умеренной до тяжелой МС или с
тромбом левого предсердия. (Уровень доказанности: C)
*см Таблицу 4 (27).
Концепция митральной комиссуротомии была
впервые предложена Brunton в 1902 г., а первая
успешная хирургическая митральная комиссуротомия была выполнена в 1920-ых
годах.
В конце 1940-ых и в
1950-ые годы как чрезпредсердная, так и чрезжелудочковая закрытая хирургическая
комиссуротомия были общепризнанными клиническими процедурами.
С появлением
искусственного кровообращения открытая митральная комиссуротомия и
протезирование МК стали хирургическими процедурами выбора для лечения МС.
Чрезкожная митральная баллонная вальвулотомия появилась в середине 1980-ых
годов. Эта процедура, при которой 1 или более больших баллончиков раздуваются
поперек МК посредством катетерного подхода, стала предпочтительной процедурой у
отдельных пациентов по сравнению с хирургическими подходами.
Механизм улучшения в результате
хирургической комиссуротомии или чрезкожной вальвулотомии связан с успешным
открытием комиссур, которые были сплавлены ревматическим процессом. Это
приводит к уменьшению градиента, увеличению рассчитываемой площади МК и, в
результате, к улушению клинической симптоматики. Степень гемодинамического и
клинического улучшения зависит от величины уменьшения трансмитрального
градиента и увеличения площади клапана клапана. Пациенты с гибким
некальцинированным клапаном и минимальным сращением подстворчатого аппарата
имеют лучшие непосредственные и отдаленные результаты в тех случаях, когда
достигнуто существенное увеличение площади клапана.
Закрытая хирургическая комиссуротомия с
чрезпредсердным или чрезжелудочковым подходом были популярны в 1950-ых годах и
в 1960-ые годы. Ранние и долгосрочное послеоперационное наблюдение показало,
что пациенты имели существенное улучшение в симптомах и выживании по сравнению
с теми, которые получали медикаментозное лечение (435–437). Закрытая
комиссуротомии остается хирургией выбора во многих развивающихся странах, но
открытая комиссуротомия является общепринятой хирургической процедурой в
большинстве учреждений Соединенных Штатов (438–441),
потому что она позволяет
осуществить прямой осмотр аппарата МК и под прямым наблюдением проводить
разделение комиссур, разделение сплавленных хорд, сухожилий и папиллярных мышц
и освобождение от депозитов кальция. Ампутация ушка левого предсердия
рекомендуется для уменьшения вероятности последующих тромбоэмболий (442). Результаты операция
зависят от морфологии аппарата МК и хирургического навыуа и и опыта. У пациентов с заметной деформацией аппарата
МК, решение для замены МК может быть сделано во время операции. Риск операции
между 1 % и 3 %, в зависимости от общего состояния пациентов (439–441). Хотя есть довольно
стабильная частота повоторных операций 4%-7%,
5-летняя выживаемость без осложнений составляет от 80% до 90%.
Чрезкожная митральная баллонная вальвулотомия была впервые
выполнена в начале 1980-ых и стала клинически одобренной техникой в 1994 г. В прошлом десятилетии были главные
достижения в методах, оборудовании и в отборе пациентов. Техника двойного
баллонирования является превичной процедурой, используемой большинством
исследователей. Сегодня, единичный баллон в форме песочных часов (Inoue balloon) используется большинством центров. Подобные,
похоже, результаты были получены с введением чрезкожной механической митральной
комиссуротомиия с металлическим вальвулотомом. Преимущество этой техники
состоит в том, что возможно многократное использования металлического
устройства после стерилизации и уменьшается стоимость лечения (443); однако, он не является
широко доступным, и поэтому ограничивается опыт этой методики. Процедура
баллонной вальвулотомии сама по себе технически оспариваема, и требует дальнейшего изучения. В высоко
оснащенных центрах большая частота успешных вмешательств и более низкая частота
осложнений
(444).
Таким образом, результаты процедуры строго зависят от опыта вовлеченных
исполнителей, который нужно рассмотривать
для создания
рекомендаций по
внедрению этой техники.
Непосредственные результаты чрезкожной
митральной вальвулотомии не отличаются от таковых при митральной комиссуротомии (444–453). Средняя площадь
клапана обычно удваивается (от 1.0 до 2.0 см2), на 50% - 60% уменьшается
трансмитральный градиент. В целом, 80%-95% пациентов имеют положительный
результат, который определяется как
площадь МК больше 1.5 см2 и уменьшение давления в левом предсердии
меньше 18 мм рт.ст. при отсутствии осложнений. Самые частые острые осложнения,
о которых сообщают в больших исследованиях, включают тяжелую МР, которая бывает
от 2% до 10%, и вторичный дефект межпредсердной перегородки. Большой дефект
межпредсердной перегородки (больше чем 1.5:1 шунт слева направо) бывает у менее
12% пациентов с техникой double-balloon и у менее 5% с техникой
Inoue balloon. Меньшие дефекты межпредсердной перегородки могут быть
обнаружены чрезпищеводной эхокардиографией у большого числа пациентов. Менее
частые осложнения включают перфорацию левого желудочка (0.5% - 4.0%),
тромбоэмболию (0.5% - 3%), и инфаркт миокарда (0.3% - 0.5%). Смертность
при баллонной вальвулотомии в больших
исследованиях составляет 1% - 2% (444-447, 453); однако, с возрастанием опыта процедуры,
смертность при чрезкожной митральной вальвулотомии у отдельных пациентов может
быть меньше чем 1% (448). Эхокардиография во время процедуры может быть ценной при
установке баллона и для оценки гемодинамики.
Данные о результатах чрезкожной баллонной
вальвулотомии немногочисленны. Event-free survival
(без смертей, повторной
вальвулотомии или протезиования МК) составляет 50%-65% от 3 до 7 лет. У пациентов с благоприятной морфологией МК
Event-free survival составляет 80%-90% (398,446,448–455). Больше 90% пациентов
Event-free survival сохраняют I или II
функциональный класс по NYHA после чрезкожной
митральной вальвулотомии. В ряде рандомизированных исследований сравнили
чрезкожную баллонную вальвулотомию с закрытой и с открытой хирургической
комиссуротомией (456–461). Эти исследования, суммированные в таблице 18, включали преимущественно молодых пациентов
(возраст 10-30 лет) с гибкими створками МК. Не было найдено существенных
различий в непосредственных гемодинамических результатах или частоте осложнений
между чрезкожной митральной вальвутомией и операцией; и в ранний
послепроцедурный период не отмечалось различий в гемодинамике, клиническом
улучшении или толерантности к нагрузке. Однако, длительные
последующие исследования
за 3-7 летний
период (459, 460) показали более
благоприятные гемодинамические и симптомные результаты при чрезкожной баллонной
вальвулотомии по сравнению с закрытой комиссуротомией. Из 2 исследований,
которые сравнивали чрезкожную баллонную вальвулотомию с открытой
комиссуротомией, в одном сообщались эквивалентные результаты (460), а в другом более
благоприятные результаты были после открытой комиссуротомии (461). Это последнее
исследование включало более старших пациентов с более высокими баллами МК по
градации Wilkins.
Непосредственные результаты, острые
осложнения и отдаленные результаты чрезкожной баллонной вальвулотомии зависят
от многих факторов. Наибольшее значение имеет тот факт, что эта процедура
должна быть выполнена в центрах с квалифицированным и опытным персоналом.
Другие факторы включают возраст, функциональный класс по NYHA,
тяжесть стеноза, конечное
диастолическое давление ЛЖ, сердечный выброс и давление заклинивания легочной
артерии
(446,448,449,453). Морфология МК является самым важным фактором,
определяющим результат (394–400,446,449,450,453,454,462), а непосредственная
поствальвулотомная гемодинамика является предиктором долговременного
клинического прогноза (448 450 453). Пациенты с клапанной кальцификацией, утолщенными
фиброзированными створками с ограниченной подвижностью и подклапанным сращением
имеют более высокий процент острых осложнений и более высокую частоту
рестенозов (Таблица 19). Поскольку успех процедуры зависит от пособности сращенных
комиссур к разъединению, присутствие заметного сращения и тяжелого кальциноза
комиссур ассоциируется с увеличением частоты осложнений и более высоким
процентом возврата симптомов (396–398). И, напротив, у
пациентов с некальцинированными гибкими клапанами, незначительным подклапанным сращением и отсутствием кальция
в комиссурах процедура может быть выполнена с высоким процентом успеха (больше
90%), низкой частотой осложнений (меньше 3%) и устойчивым улучшением от 80% к
90% за 3-7-летний период (397,398,400,446,448,450,453,454).
Относительные противопоказания для
чрезкожной баллонной вальвулотомии включают наличие тромба левого предсердия и
значительная (3+, 4+) МР. Перед процедурой рекомендуется провести
чрезпищеводную эхокардиографию для определения наличия тромба левого
предсердия; при этом специально исследуется ушко левого предсердия. Если тромб
найден, 3 месяца антикоагуляции
варфарином может привести к рассасыванию тромба. Предложена
прогностическая модель для предсказания рассасывания тромба левого предсердия у
кандидатов на чрезкожную митральную комиссуротомию. Комбинация клинического
функционального класса и эхокардиографии тромба левого предсердия предсказывает
результат пероральной антикоагуляции для рассасывания тромба (463).
В центрах с квалифицированным опытным
персоналом чрезкожная баллонная вальвулотомия должна быть начальной процедурой
выбора для симптомных пациентов с умеренным или тяжелым
МС, имеющих благоприятную морфологию клапана при
отсутствии значительной МР или тромба левого предсердия. Сообщают об
эхокардиографических параметрах, которые могут предсказать риск развития
тяжелой МР после чрезкожной митральной вальвулотомии техникой Inoue
(464), и
полная эхокардиографическая оценка (397, 398, 400) позволяет выделить пациентов
с менее благоприятным долговременным прогнозом (Таблицы 17 и 19). У
бессимптомных пациентов с благоприятной морфологией клапана чрезкожную
митральную вальвулотомию можно рассматривать, если есть данные
гемодинамического воздействия на давление в левом предсердии или легочное
кровообращения (систолическое давление в легочной артерии больше 50 мм рт.ст. в
покое или больше 60 мм рт.ст. при нагрузке); сила доказательности для этой
рекомендации низкая, потому что нет сравнительных данных о результатах
чрезкожной баллонной вальвулотомии и таковых при
медикаментозной терапии
у бессимптомных пациентов. Нет единого мнения, что пациенты с выраженными симптомами с менее благоприятной
морфологией клапана должны подвергнуться этой катетеризационной процедуре (465)
(рис. 7; Таблица 19). В тоже время, у этих
пациентов есть более высокая частота острых осложнений и более низкий процент event-free survival (приблизительно 50% за 5
лет у этих пациентов по сравнению с 80%-90% у пациентов с благоприятной
морфологией клапана). Это должно быть
сопоставлено со средней внутрибольничной смертностью при хирургическом протезировании
МК в 6% (164,165), которая возрастает до
16% в недостаточно оснащенных центрах
(166), и ожидаемым
долговременным прогнозом. Во многих случаях протезирование МК предпочтительнее
для пациентов с тяжелым кальцинозом и деформацией клапана.
Пациенты, которых рассматривают для
вмешательства, должны подвергнуться оценке посредством анамнеза, осмотра,
двумерной эхокардиографии и допплерэхокардиографии. Состояние и подвижность
аппарата МК и комиссур должны быть оценены 2-ой эхокардиографией, а
трансмитральный градиент, площадь МК и давление в легочной артерии должны быть
измерены посредством допплерэхокардиографии. При несоответствии между
симптомами и гемодинамикой может быть проведен стандартный нагрузочный
гемодинамический тест. Если пациенту предполагается провести чрезкожную митральную вальвулотомию, он должен
подвергнуться чрезпищеводной эхокардиографии для исключения тромба левого
предсердия и оценки тяжести МР. Если найден тромб левого предсердия, повторная
чрезпищеводнаяgeal эхокардиограмма может быть
выполнена после
нескольких месяцев антикоагуляции. Чрезкожная митральная вальвулотомия может
быть благополучно выполнена после разрешения тромба. Если есть подозрение
(основанное на
осмотре или
эхокардиограмме), что тяжесть МР соответствует 3+ или 4+, должна быть выполнена
вентрикулография левого желудочка. Митральная баллонная вальвулотомия не должна
выполняться у пациентов, которые имеют степень 3+ или 4+ МР. Чрезкожная
митральная баллонная вальвулотомия должна выполняться только квалифицированными
хирургами в учреждениях с большим опыт
в выполнении техники (444, 447). Таким образом, решение проводить чрезкожную баллонную
вальвулотомию или хирургическую комиссуротомию зависит от опыта хирурга и учреждения. Из-за менее инвазивной природы
чрезкожной баллонной вальвулотомии по сравнению с хирургическим вмешательством
подходящих пациентов без симптомов или с симптомами II функционального класса
по NYHA можно рассматривать для катетеризации (Рис. 5 и 6).
Таблица 18. Рандомизированные исследования митральной баллонной вальвулотомии
и хирургической комиссуротомии
Митральный Площадь митр.
градиент
клапана Без
-------------------- ----------------------- повторых
Автор, год Средний Процедура
Число Возраст, Средние
Рестенозы вмешательств NYHA ФК I
период
пациентов лет
баллы
До После До После (%) (%)
(%)
Patel et al., 1991 (456) Непосред.
ЧМБВ 23 30±11 6.0 12±4 4±3 0.8±0.3 2.1±0.7* — — 91
ЗК 22 26±26 6.0 12±5 6±3 0.7±0.2 1.3±0.3 — — —
Turi et al., 1991 (457) 7 мес ЧМБВ 20 27± 8 7.2 18±4 10±2 0.8±0.2 1.6±0.2 — — —
ЗК 20 28± 1 8.4
20±6 12±2 0.9±0.4 1.7±0.2 — — —
Arora et al., 1993 (458) 22 мес
ЧМБВ 100 19± 5 — — — 0.8±0.3 2.3±0.1 5 — —
ЗК 100 20± 6 — — — 0.8±0.2 2.1±0.4 4
— —
Reyes et al., 1994 (459) 3 г ЧМБВ 30
30± 9
6.7 — — 0.9±0.3 2.4±0.4* 10 — 72
ЗК 30 31± 9
7.0 — — 0.9±0.3 1.8±0.4 13 — 57
Ben Farhat et al., 1998 (460) 7 лет
ЧМБВ 30 29±12 6.0 — — 0.9±0.2 1.8±0.4 —
90 87
ОК 30 27± 9 6.0 — — 0.9±0.2 1.8±0.3 —
93 90
ЗК 30 28±10 6.0 — — 0.9± 0.2 1.3±0.3 — 50 33
Cotrufo et al., 1999 (461) 38 мес
ЧМБВ 111 47±14 7.6 — — 1.0± 0.2 1.8±0.3 28
88 67
50 мес ОК 82 49±10 8.2 — — 1.0±0.2 2.3±0.3
18 96 84
-------------------------------------------------------------------------------------------------------------------------------------------------------------------------------------------------------------------------------------------------------
Прочерк указывает, что
данные не были доступны. *Достоверное
(p меньше 0.05) увеличение
площади митрального клапана при чрезкожной митральной
баллонной вальвулотомии (ЧМБВ) в
сравнении с хирургической
комиссуротомия.
ЗК обозначает закрытую комиссуротомию; ФК, функциональный
класс; NYHA,
New York Heart Association;
ОК, открытая
комиссуротомия; После, после процедуры; До, до процедуры.
Таблица 19. Эхокардиографические предикторы исхода при чрезкожной митральной
баллонной вальвулотомии
Средний
период Число Survival Free
Автор,
год наблюд., мес Эхо
критерии пациентов Возраст, г Выживаемость of Events Events
Cohen et al., 1992 36±20
Баллы
меньше 84 — — 68% за 5 лет Смерть, МКП, повторная
ЧМБВ
(446) или
равно 8
Баллы больше 8 52 — — 28% за 5 лет
Palacios et al., 1995 20±12 Баллы
меньше 211 48±14
98% за 4 г 98% за 4 года Смерть, МКП, симптомы III–IV ФК
(454 ) или равно 8
по NYHA
Баллы больше 8 116 64±11 39% за 4 г 39% за 4 года
Dean et al., 1996 38±16
Баллы
меньше 272 49±13 95% за 4 г
—
Смерть
(449) или равно 8
Баллы от
8 до 12 306 58±15 83% за 4 г
—
Баллы больше 12 24 58±15
24% за 4 г —
Iung et al., 1996* 32±18 Группа 1 87 — 89%
за 3
года Смерть, МКП, повторная
ЧМБВ,
(397) симптомы
III–IV ФК
Группа 2 311 46±13 — 78% за 3 года
Группа 3 130
— 65%
за 3 года
Cannan et al., 1997 22±10 Включения Ca
- 120 — —
86% за 3года Смерть, МКП, повторная ЧМБВ
(398)
Включения Ca+ 29 — —
40% за 3 года
Palacios et al., 2002 50±44 Баллы больше
8 278 63±14 82% за 12
лет 38% за 12 лет Смерть,
МКП, повторная ЧМБВ
(453) Баллы
меньше 8 601 51±14 57% за 12 лет 22% за 12 лет
Прочерк указывает, что
данные не были доступны. Эхокардиографические
(Эхо) баллы основаны на бальной
системе Wilkins et al. (400). *Echocardiographic
group based on valve flexibility, chordal fusion, and valve
calcification in Iung et al. (397).
Включения
Ca указывают на наличии кальциноза комиссур; ФК, функциональный
класс; МКП, протезирование митрального клапана; NYHA, New York Heart Association;
ЧМБВ, чрезкожная
митральная баллонная вальвулотомия.
3.4.9. Показания для операции при
митральном стенозе
Класс I
1. Операция на МК (пластика, если
это возможно) показана пациентам с симптомным (III–IV функциональный класс по NYHA)
умеренным или тяжелым МС*, когда 1) чрезкожная митральная баллонная
вальвулотомия недоступна, 2) чрезкожная
митральная баллонная вальвулотомия
противопоказана из-за тромба левого предсердия, который сохраняется несмотря на
антикоагуляцию, или потому, что есть сопутствующая умеренная или тяжелая МР,
или 3) морфология клапана неблагоприятна для чрезкожной митральной баллонной
вальвулотомии у пациента с приемлемым операционным риском. (Уровень
доказанности: B)
2. Симптомным пациентам с умеренным
или тяжелым МС*, у которых также имеется умеренная или тяжелая МР, показано
протезирование МК, если пластика клапана невозможна во время операции. (Уровень доказанности: C)
Класс IIa
Протезирование МК может быть
рекомендовано пациентам с тяжелым МС* и тяжелой легочной гипертензией (систолическое давление в легочной артерии
больше 60) с симптомами I-II функционального класса по NYHA, которые не рассматриваются как
кандидаты на чрезкожную митральную баллонную вальвулотомию или хирургическую
пластику МК. (Уровень доказанности: C)
Класс IIb
Пластику МК можно рассматривать у
бессимптомных пациентов с умеренным или тяжелым МС*, у которых были повторные
тромбэмболии при адекватной антикоагуляции, и
которые имеют благоприятную морфологию
клапана для пластики. (Уровень доказанности: C)
Класс III
1. Пластика МК при МС не
показана пациентам с незначительным (легким) МС. (Уровень доказанности: C)
2. Закрытая
комиссуротомия не должна выполняться у пациентов, подлежащих пластике МК;
открытая комиссуротомия более предпочтительный подход. (Уровень
доказанности: C)
*См Таблицу 4 (27).
Протезирование МК является общепринятой хирургической процедурой у
пациентов с тяжелым МС, которые не являются
кандидатами на хирургическую комиссуротомию или чрезкожную митральную
вальвулотомию. Периоперационная смертность при протезировании МК зависит от
многих факторов, включая функциональный статус, возраст, функцию ЛЖ, сердечный
выброс, сопутствующие болезни и сопутствующую ИБС. У молодого здорового
человека протезирование МК может быть выполнена с риском меньше чем 5%; однако,
у пожилого пациента с сопутствующими болезнями или с легочной гипертензией на
уровне системной АГ периоперационная смертность протезирования МК может
достигать 10%-20 % (166, 167). Протезирование МК с сохранением подстворчатого аппарата
помогает в поддержании функции ЛЖ (466), но это может быть особенно трудным у пациентов
с ревматическим МС. Существукт альтернативный подход к сохранению желудочка такой, как искусственная хордальная
реконструкция перед протезированием МК (467, 468). Осложнения протезирования МК включает тромбоз
клапана, разрыв клапана, клапанную
инфекцию, дисфункцию
клапана тромбоэмболию. Они обсуждены в Разделе 7.3. Есть также известный риск
долговременной антикоагуляции у пациентов с механическим протезом.
Если есть существенный кальциоз, фиброз и
подстворчатое сращение аппарата МК, успешная комиссуротомия или чрезкожная
баллонная вальвулотомия маловероятны; необходимо протезирование МК. Учитывая
риск протезирования МК и возмлжные долгосрочные
осложнения протеза клапана, есть более строгие показания для операции на МК у
этих пациентов с кальцинированными фиброзными клапанами. У пациента с
симптомами функционального класса III
по NYHA, обусловленными тяжелым МС или комбинацией
МС/МР, протезирование МК приводит к отличному симптомному улучшению. Необходимо
избкгать отсрочки операции до появления симптомов IV функционального класса,
потому что операционная смертность высока и долговременные результаты
неоптимальны. Однако, если у пациента имеется сердечная недостаточность IV функционального
класса по NYHA операцию нельзя отрицать, потому что
прогноз без
хирургического вмешательства плохой. Подвергается сомнению, что бессимптомные
или незначительно симптомные пациенты с тяжелым МС (площадь клапана меньше 1 см2)
и тяжелой легочной гипертензией (систолическое давление в легочной артерии
больше 60 - 80 мм рт.ст.) должны подвергаться протезированию МК для
предотвращения недостаточности ПЖ, но, вообще, операция рекомендуется таким
пациентам. Общепризнано, что пациенты с такой тяжелой легочной гипертензией
редко является бессимптомными.
3.4.10. Лечение
пациентов после вальвулотомии или комиссуротомии
Симптомное улучшение
наступает почти сразу после успешной чрезкожной баллонной вальвулотомии или
хирургической комиссуротомии, хотя объективное измерение максимума потребление
кислорода показывает продолжение улучшения еще несколько месяцев после операции
вследствие медленно прогрессирующего улучшения метаболизма скелетных мышц (469). Гемодинамические
показатели до и после чрезкожной вальвулотомии или хирургической комиссуротомии
подтвердили снижение давления в левом предсердии, давления в легочной артерии и
легочного артериолярного сопротивления и улучшение сердечного выброса (470–473). У пациентов со
значительной недостаточностью правого сердца после катетерного или
хирургического устранения обструкции МК
вдыхание окиси азота, внутривенное введение простациклина или
антагониста эндотелина могут быть полезны в снижении легочного сосудистого
сопротивления и легочной гипертензии (474). Сообщается о постепенном регрессе легочной гипертензии в ьечение
месяцев (470–472).
Возвращение симптомов после успешной
хирургической комиссуротомии, как сообщают, происходит у приблизительно 60% пациентов после 9 лет (405, 435, 475); однако, рестеноз из
этих 60% составляет меньше 20% пациентов (475). У пациентов с адекватным начальным результатом
прогрессирование МР. и развитие других клапанных или коронарных проблем
наиболее часто вызывают возврат симптомов (475). Таким образом, когда у пациенты появляются
симптомы в поздний период после комиссуротомии, необходимо посредством всесторонней оценки искать другие причины.
Пациенты, подвергнувшиеся чрезкожной митральной вальвулотомии с неблагоприятной
морфологией МК, имеют более высокую частоту возврата симптомов за 1-2-летний
период наблюдения вследствие или изначального неадекватного результата или
рестеноза
(476).
Лечение пациентов после успешной
чрезкожной баллонной вальвулотомии или хирургический комиссуротомии такое же,
как и у бессимптомных пациентов с МС. Базовая эхокардиография должна быть
выполнена после процедуры для получения основных показателей послеоперационной
гемодинамики и исключения существенных осложнений, таких как МР, дисфункция ЛЖ или дефект межпредсердной
перегородки (в случае чрезкожной вальвулотомии). Эта эхокардиография должна
быть выполнена не раньше 72 часов после процедуры, потому что острые
изменения податливости предсердия и желудочка сразу после процедуры
снижают надежность полупериода в вычислении пощади клапана (402, 403). Пациенты с тяжелой МР или большим дефектом пежпредсердной
перегородки должны быть рассмотрены для ранней операции; однако, большинство
маленьких шунтов слева-направо на уровне предсердия закрываются спонтанно в
течение 6 месяцев. У пациентов с фибрилляцией предсердий в анамнезе варфарин
должен быть повторно назначен спустя 1 - 2 дня после процедуры.
Анамнез, осмотр, рентгенография органов
грудной клетки и ЭКГ должны быть проведены
ежегодно у пациентов, которые сохраняются бессимптомными или минимально
симптомными. Должна проводиться профилактика инфекционного эндокардита (Раздел
2.3.1) и возвратного ревматизма (Раздел 2.3.2.3; Таблица 11) (45). Антикоагуляция
рекомендуется пациентам с фибрилляцией предсердий или с фибрилляцией предсердий
в анамнезе, как частный случай всех пациентов с МС. При возвращении
симптомов должна быть выполнена расширенная
двумерная и допплерэхокардиография для оценки гемодинамики МК и давления
в легочной артерии и исключения существенной МР или шунта слева направо. Как и всем пациентам с МС, исследование
гемодинамики при нагрузке может быть
показано пациентам с несоответствием клинических и гемодинамических данных.
Повторная чрезкожная баллонная
вальвулотомия может быть выполнена пациентам,
у которых есть рестеноз после
предшествующей
хирургической комиссуротомии или баллонной вальвулотомии (378, 477). Результаты этих процедур
адекватны у многих
пациентов, но могут быть менее удовлетворительные, чем конечные результаты первичной вальвулотомии, потому что
при вторичной процедуре обычно клапан
больше деформирован, кальцифицирован и
фиброзирован, чем при первичной
процедуре (395, 477, 478). Протезирование МК нужно рассмотривать у таких пациентов с повторными тяжелыми
симптомами и резкой деформацией митрального аппарата.
3.4.11. Частные вопросы
3.4.11.1. Беременные
МС часто бывает у
молодых женщин, которые находятся в детородном возрасте. Увеличенный объем
циркулирующей крови, увеличенный сердечный выброс и тахикардия, связанные с
беременностью, могут вызвать сложные проблемы у пациента с МС и рассматриваются
в Разделе 5.5.1. Чрезкожная митральная вальвулопластика может быть выполнен с
немногими осложнениями или вообще без осложнений у матери или плода с
отличными клиническими и
гемодинамическими результатами (479).
3.4.11.2. Пожилые
пациенты
В настоящее время
появляется все больше и больше пожилых
пациентов с симптомным МС, наиболее вероятно из-за изменений
естественного течения болезни (383, 384). Пожилые пациенты более часто имеют тяжелый
кальциноз и фиброз створок МК, с существенным подклапанным сращением. У
пациентов старше 65 лет частота
успешной чрезкожной вальвулотомии ниже (меньше 50%) чем по имеющимся сообщениям
у более молодых пациентов. Процедурная
смертность составляет 3 %, повышается риск
осложнений, включая тампонаду перикарда у
5 % и томбоэмболии у 3 %; однако, у отдельных пациентов с благоприятной
морфологией клапана процедура может быть проведена благополучно с хорошим
промежуточным результатом (384). Долговременное клиническое улучшеие значительно меньше и
смертность выше у пожилых пациентов,
чем в более молодом возрасте (480).
3.5. Пролапс митрального
клапана
3.5.1. Патофизиология и
естественное течение
ПМК обозначает
систолическое выбухание одной или обеих
митральных створок в левое предсердие с или без МР. При использовании
общепринятых эхокардиографических критериев для диагностики ПМК (пролабирование
клапана на 2 мм или больше выше
митрального кольца в парастернальной позиции по длинной оси и в других позициях [481]),
распространенность этой
патологии 1% - 2.5% населения (482). ПМК может быть с или без утолщения створок (5 мм
или больше, измеренные в период диастазиса) и с или без МР.
Первичный ПМК может быть семейным или
несемейным. Это межхордальное выбухание из-за избыточности ткани створки,
которое включает как неровные так и гладкие участки вовлеченных створок (483). Основная микроскопическая особенность
первичного ПМК заключается в пролиферации спонгиозной ткани, разрыхлении
миксоматозной соединительной ткани и фиброзе между предсердиями (толстый слой
коллагена и эластичная ткань, которые формируют предсердную часть створок) или
желудочками (плотный слой коллагена, который формирует основную поддержку
створок). Миксоматозная пролиферация мукополисахаридсодержащей спонгиозной
ткани вызывает фокальное разрушение фибоза. Вторичные эффекты первичного
синдрома ПМК включают поверностный фиброз створок МК, истончение и/или
удлинение хорд и нарушение желудочковой жесткости. Депозиты фибрина часто
формируются в левом предсердном углу
МК.
Семейный ПМК передается автосомно (484,485), и можно
идентифицировать несколько хромосомных локусов (486–488). Первичный ПМК встречается с большой частотой у
пациентов с синдромом Марфана и другими заболеваниями соединительной ткани (483, 489 – 491). Можно подумать, что первичный синдром
ПМК представляет собой обобщенную болезнь соединительной ткани. Увеличение
случаев ПМК при болезни Виллебранда и других коагулопатиях, первичной
гипомастии и различные заболевания соединительной ткани поддерживает концепцию
ПМК как результат дефектного эмбриогенеза клеточных линий мезенхимального
происхождения
(492).
Торакальные скелетные аномалии, типа прямого грудного позвоночника и pectus excavatum обычно связываются с ПМК.
Аускультативные данные при ПМК, когда они
имеются, могут включать клик или многократные клики, которые передвигаются в
пределах систолы в зависимости от размеров ЛЖ и/или поздний систолический или
голосистолический шум МР. Может присутствовать дилатация левого предсердия и расширение ЛЖ в зависимости от наличия и тяжести МР. Могут вовлекаться и другие
клапаны. Пролапс трикуспидального клапана встречается у 40 % пациентов с ПМК (485). Пролапсы легочного и аортального клапанов
обнаруживаются у 2%-10% пациентов с ПМК (483). Отмечается увеличение частоты случаев ПМК
ассоциированных с дефектом межпредсердной перегородки тива secundum и/или левсторонних атриовентрикулярных дополнительных трактах
проведения и наджелудочковых аритмиях.
Естественное течение бессимптомного ПМК
является неоднородным и может изменяться от легкого с нормальной
продолжительностью жизни до неблагоприятного с существенной заболеваемостью или
смертностью МР бывет от отсутствия до
тяжелой. Наиболее частым предиктором сердечно-сосудистой смертности является умеренная и тяжелая МР, и менее частым - фракция выброса ЛЖ
меньше 0.50 (493). Данные эхокардиографии
об утолщении створок МК (5 мм или больше) являются также предиктором
осложнения, связанных с ПМК (Таблица 20) (494–499). У большинства пациентов синдром ПМК
ассоциируется с хорошим прогнозом (500, 501). Корригированная по возрасту частота
выживаемости и для мужчин и для женщинс ПМК подобна таковой у людей без ПМК (485).
Увеличение степени МР.у пациентов с
ПМК может привести к прогрессирующей
дилатации левого предсердия и
желудочка. Дилатация
левого предсердия может привести к фибрилляции предсердий, а умеренная и тяжелая МР может, в конечном счете, привести к дисфункции ЛЖ и
застойной сердечной недостаточности (502). Может иметь место легочная гипертензия с
присоединением дисфункции ПЖ. У части пациентов после начального длительного
бессимптомного периода все эти процессы могут перейти в ускоренную фазу, в
результате которой развиваются дисфункция левого предсердия и левого желудочка
и фибрилляция предсердий. В некоторых случаях происходит спонтанный разрыв
хорды МК (502). Серьезным осложнением ПМК является
инфекционный эндокардит; ПАК является предполагаемой причиной разавития
инфекционного эндокардита у многих пациентов (490 502 503). Поскольку абсолютное число случаев чрезвычайно малое для всей популяции с ПМК,
есть большое расхождение мнений о риске эндокардита при ПМК (504).
Тромбоэмболию можно предположить у
пациентов с явными симптомами нарушения кровообращения в елазной или задней
мозговой артериях (505). Ряд исследований показали увеличенную вероятность
церебро-васкулярных осложнений
у пациентов моложе 45
лет с ПМК по сравнению с подобной популяцией без ПМК (506).
Внезапная смерть является редким
осложнением ПМК, случается у меньше 2%
пациентов с ПМК в течение длительного наблюдения (495, 500–511), с ежегодной
смертностью меньше 1%. Вероятной причиной смертности являются желудочковые тахиаритмии, приводящие к
увеличению сложной желудочковой эктопии (электрической нестабильности мокарда),
наблюдающейся при суточном мониторировании ЭКГ у пациентов с ПМК, у которых
была внезапная смерть (512,513). Хотя и нечастая, но самая высокая частота
внезапной смерти сообщается при семейной форме ПМК; у некоторых пациентов было
также отмечено удлинение интервала QT (502 514).
3.5.2. Оценка и
наблюдение бессимптомных пациентов
Класс I
Эхокардиография
показана для диагностики ПМК и оценки МР, морфологии створок и
желудочковой компенсации у бессимптомных пациентов с физикальными признаками
ПМК. (Уровень доказанности: B)
Класс IIa
1. Эхокардиография может
достоверно исключить ПМК у бессимптомных пациентов, который был диагностирован без клинических подтверждений
диагноза. (Уровень доказанности: C)
2. Эхокардиография может
быть эффективной для стратификации риска у бессимптомных пациентов с
физикальными признаками ПМК или с подтвержденным ПМК. (Уровень доказанности:
C)
Класс III
1. Эхокардиография не
показана для исключения ПМК у бессимптомных пациентов с неуточненными
симптомами при отсутствии харктерного для ПМК сочетания клинических симптомов
или физикальных данных, свойственных ПМК, или при нормальном семейном анамнезе.
(Уровень доказанности: B)
2. Рутинная повторная
эхокардиография не показана бессимптомным пациентам с ПМК без МР или с ПМК с
легкой МР без динамики клинических данных или симптомов. (Уровень
доказанности: C)
Первичная
диагностическая оценка пациента с ПМК начинается с осмотра (502, 515). Главной
аускультативной особенностью этого
синдрома является среднесистолический
клик, высокочастотный звук короткой продолжительности. Один или более кликов
могут значительно изменяться по интенсивности и расположению в систоле в
зависимости от состояния нагрузки ЛЖ и
сократимости миокарда. Клики являются следствием внезапного напряжения аппарата
МК, когда створки пролабируют в левое предсердие в течение систолы.
Среднедиастолический клик может сопровождаться поздним систолическим шумом,
который является обычно средне- или высокочастотным и наиболее громким на
верхушке сердца. Иногда шум имеет
музыкальный или гудящий тон. Характер и интенсивность шума также изменяются при
определенных условиях,
от короткого и почти неслышимого до голосистолического и громкого. Аускультация
в динамике часто полезна для установления диагноза ПМК (515). Изменения конечном
диастолическом объеме ЛЖ приводят к изменениям в расположении в систоле
среденесистолического клика (-ов) и шума. Когда конечный диастолический объем
уменьшается (например, при переходе в вертикальное положение) ПМК возникает в
раннюю систолу и комплекс клик-шум происходит сразу после первого сердечного
тона. Напротив, любой маневр, который увеличивает объем крови в желудочке, уменьшает сократимость миокарда или
увеличивает постнагрузку ЛЖ (типа сидения на корточках) удлиняет время от
начала систолы до возникновения ПМК, и комплекс клик-шум перемещается ко
второму сердечному тону. ПМК может быть
и при отсутствии этих классических аускультативных данных, и клики могут быть непостоянными.
Хотя ЭКГ может и иметь некоторую
информационную ценность у пациентов с ПМК, она часто нормальная. При ПМК
встречаются неспецифические изменения интервала ST-T,
инверсия зубца T, заметные зубцы Q и удлинение интервала QT.
Суточное мониторирование ЭКГ или эпизодическое мониторирование могут быть
полезны для документирования аритмии у
пациентов с сердцебиениями. Они не показаны как рутинный тест у бессимптомных
пациентов. Большинство обнаруженных аритмий не угрожают жизни, и у пациенов,
часто жалующихся на сердцебения, суточное мониторирование ЭКГ не показывает
патологии.
Двумерная эхокардиография и
допплерэхокардиография наиболее полезные неинвазивные методы для диагностики
ПМК. Пролабирование клапана на 2 мм или больше выше митрального кольца в
парастернальной позиции по длинной оси и других позициях, особенно, когда
адаптация створки происходит на предсердной части плоскости кольца, указывает
высокую вероятность ПМК. Нет единого мнения относительно надежности
эхокардиографического изображения неровности передней створки, когда используется только апикальная 4-х
камерная позиция (496, 516). Утолщение створки на 5 мм или больше является
патологическим и делает диагноз ПМК более уверенным. Утолщение створки часто
ассоциируется с расширенным митральным
кольцом и удлинением хорд (502). Отсутствие или наличие
МР является важным фактором и ПМК более
вероятен, когда МР обнаруживается как высокоскоростной эксцентричный поток в
поздней систоле (517).
Внушение - главная часть лечения пациентов
с ПМК. Пациентов без симптомов или с незначительными симптомами и с признаками
незначительного пролапса необходимо убедить в благоприятном прогнозе.
Поощряется здоровый образ жизни и регулярное физические нагузки (502, 515).
Профилактика антибиотиками для
предотвращения эндокардита при проведении процедур, связанных с бактериемией,
рекомендуется для большинства пациентов с уточненным диагнозом ПМК, особенно,
если есть ассоциированная МР. (518). Комитет рекомендует, что пациенты без МР, но с утолщением
створок, удлинением хорд, расширением левого предсердия или дилатацией ЛЖ,
должны получить профилактику эндокардита (494–499) (см. Раздел 2.3.1).
Таблица 20. Применение эхокардиографии для для стратификации риска при
пролапсе митрального клапана (МК)
Исследование, год Число
Пациентов Особенности исследования
Результаты p <
Chandraratna et al., 1984 (494) 86 створки
МК больше 5 мм áСердечно-сосудистая
патология (60% против 6%; 0.001
синдром
Марфана, ПТК, МР, дилатация
восходящей аорты)
Nishimura et al., 1985 (495) 237 створки МК 5 мм или
больше á Сумма внезапных смертей, эндокардита, и 0.02
мозговых
эмболий
ВДЛЖ 60 мм или больше
áМКП (26% против. 3.1%) 0.001
Marks et al., 1989 (496) 456 створки МК 5 мм или больше áЭндокардиты
(3.5% против 0%) 0.02
á Умеренная-тяжелая МР (11.9% против 0%) 0.001
á МКП (6.6% против
0.7%) 0.02
á Инсульт (7.5% против
5.8%) НД
Takamoto et al., 1991 (497) 142 створки МК 3 мм или больше, á Разрыв хорды (48% против 5%)
избыточный, недостаточный эхо прогноз
Babuty et al., 1994 (498) 58
неопределенная толщина МК Нет
связи с комплексными желудочковыми НД
аритмиями
Zuppiroli et al., 1994 (499) 119 створки
больше 5 мм á Complex ventricular arrhythmias 0.001
Перепечатано из ACC/AHA/ASE 2004 Guidelines for the Clinical
Application of Echocardiography.
ВДЛЖ
обозначает внутренний диаметр левого желудочка; МР, митральная
регургитация; МК, митральный клапан; МКП, мтрального клапана протезирование; НД, недостоверно; ПТК, пролапс
трикуспидального клапана. á обзначает увеличение.
3.5.3. Оценка и лечение симптомных
пациентов
Класс I
1. Терапия аспирином (75 - 325 мг в
день) рекомендуется симптомным пациентам с ПМК, которые перенесли церебральные
преходящие ишемические атаки. (Уровень доказанности: C)
2. У пациентов с ПМК и фибрилляцией предсердий
терапия варфарином рекомендуется пациентам в возрасте старше 65 лет или
пациентам с гипертензией, шумом МР, или с анамнезом сердечной недостаточности.
(Уровень доказанности: C)
3. Терапия аспирином (75 - 325 мг в
день) рекомендуется пациентам с ПМК и фибрилляцией предсердий в возрасте меньше
65 лет и без МР, гипертензии или сердечной недостаточностив анамнезе.
(Уровень доказанности:C)
4. У пациентов с ПМК и инсультом в
анамнезе терапия варфарином рекомендуется пациентам с МР, фибрилляцией предсердий
или тромбом левого предсердия. (Уровень доказанности: C)
Класс IIa
1. У пациентов с ПМК и инсультом в
анамнезе, не имеющих МР, фибрилляции предсердий или тромба левого предсердия
терапия варфарином может быть назаначена пациентам с эхокардиографическими
признаками утолщения (5 мм или больше) и/или увеличения створок клапана. (Уровень
доказанности: C)
2. У пациентов с ПМК и инсультом в
анамнезе аспирин может быть назначен пациентам у которых нет МР, фибрилляции
предсердий, тромба левого предсердия или эхокардиографических признаков
утолщения (5 мм или больше) или увеличения створок клапана. (Уровень
доказанности: C)
3. Терапия варфарином может быть
назначена пациентам с ПМК с преходящими ишемическими атаками несмотря на
аспиринотерапию. (Уровень доказанности:
C)
4. Терапия аспирином (75 - 325 мг в
день) может быть полезна у пациентов с ПМК и с инсультом в анамнезе, которым
противопоказаны антикоагулянты. (Уровень доказанности: B)
Класс IIb
Терапия аспирином (75 - 325 мг в
день) может обсуждаться для пациентов с синусовым ритмом с
эхокардиографическими признаками ПМК с высоким риском. (Уровень доказанности:
C)
Часть пациентов сообщают своим врачам об 1
или больше симптомов, связанных со следующим синдромом: сердцебиения, при этом
суточное мониторирование ЭКГ не показывает аритмий; атипичная боль в грудной
клетке, которая редко напоминает
классическую стенокардию; одышка и слабостьь, когда объективная проба с
физической нагрузкой не показывает снижения толерантности к физической
нагрузке; психоневрологические жалобы, панические атаки у многих пациентов
и тому подобное (502). Bankier и Littman сообщают, что
существенное число пациентов с
агорафобией также имеет
ПМК, что 45 % пациентов с панической
дезорганизацией имеют ПМКMVP и,
что значимыми предикторами для сердцебиений у этих пациентов являются
депрессия, низкая самооценка здоровья,
алкогольная интоксикация у
женщин, и злоупотребление кофе и физическая детеренированность у
мужчинах
(519).
Транзиторныем эпизоды церебральной ишемии
учащаются у пациентов с ПМК, и у некоторых пациентов развивается
инсульт. Сообщают о
проходящей слепоте (амавроз), ограничение (выпадение) полей зрения и окклюзии
артерии сетчатки; иногда нарушения зрения сохраняются (506,520–522).
Роль аускультации сердца и эхокардиографии
для оценки симптомных пациентов с ПМК такая же как и у пациентов без симптомов.
Показания к профилактике антибиотиками для предупреждения эндокардита также не
меняются.
Пациенты с ПМК и сердцебиениями,
связанными с незначительными тахиаритмиями или с повышенной адренергической
симптоматикой, и пациенты с болью в
грудной клетке, беспокойством или повышенной утомляемостью хорошо поддаются
терапии бета-блокаторами (523). Во многих случаях, однако, устранение раздражителей, таких
как кофеин, алкоголь и сигареты, можетт
быть достаточным для устранения симптомов. У пациентов с повторяющимися
сердцебиеними, постоянными или вызванными активизирющими обстоятельствами,
суточное мониторирование ЭКГ может выявить наличие или отсутствие аритмий при манифестации
симптомов и выбрать соответствующее лечение имеющихся аритмий.
Показания для электрофизиологического
исследования такие же, как и в общей популяции (например, клиническая смерть,
повторяющиеся обмороки неизвестной этиологии и симптомная или
продолжительная желудочковая
тахикардия)
(524).
Ортостатические симптомы вследствие
постуральной гипотензии и тахикардии лучше всего лечатся увеличением ОЦК
(допускается употребление жидкости и поваренной соли). Лечение
минералокортикоидами или клонидином может понадобиться в тяжелых случаях. Можно
рекомендовать ношение эластичных чулков.
Ежедневный прием аспирина (75 - 325 мг в
день) рекомендуется пациентам с ПМК с
докуметально подтвержденными преходящими мозговыми эпизодами, с синусовым ритмом,
без тромба предсердия. Такие пациенты также должны не курить и не
принимать оральных контрацептивов.
Руководство The American Stroke Association (524a) рекомендует аспирин пациентам с ПМК, у которых был ишемический инсульт (класс IIa,
уровень доказанности C), босновывая это на доказанности эффективности
антиагреганотов при всех инсультах. Нет рандомизированных испытаний,
подтверждающих эффективность конкретной
антитромботической терапии для
подгруппы пациентов с инсультом и ПМК. В настоящем руководстве, комитет
рекомендует аспирин тем пациентам с ПМК, перенесшим инсульт, у которых нет МР, фибрилляции предсердий, тромба левого предсердия или
эхокардиографических признаков утолщения (5 мм или больше) или увеличения
створок клапана. Напротив, долговременная терапия антикоагуляции варфарином
рекомендуется (класс I) пациентам после инсульта с ПМК, у которых имеется МР,
фибрилляция предсердий или тромб левого предсердия. При отсутствии этих признаков варфарин также
рекомендуется (класс IIa) у пациентов после
инсульта с ПМК, имеющих эхокардиографические признаки утолщения (5 мм или
больше) или увеличения створок клапана и у пациентов с ПМК, с преходящими
возвратными ишемическими атаками на фоне приема аспирина. В этих ситуациях
международное нормализованное отношение (МНО) должно поддерживаться между 2.0 и
3.0. У пациентов с ПМК и фибрилляцией предсердий терапия варфарином показана в
возрасте старше 65 лет и тем, у кого ксть МР, гипертензия или сердечная
недостаточность в анамнезе (МНО 2.0 - 3.0). Аспирин приемлем у пациентов с
фибрилляцией предсердий, которые моложе 65 лет, без МР и без гипертензии или
сердечной недостаточности в анамнезе (525 526). Ежедневный прием аспирина часто рекомендуется
пациентам с эхокардиографическим признаками высокого риска.
Здоровый образ жизни и регулярные физические нагрузки
рекомендуются большинству пациентов с ПМК, особенно бессимптомным пациентам (511,526). Нет единого мнения о развитии вызванной физической нагрузкой
ишемии у некоторых пациентов с ПМК (527,528). Запрещение заниматься
спортом рекомендуется при умеренном расширении ЛЖ, дисфункции ЛЖ,
неуправляемыми тахиаритмиями, удлиненном интервале QT, беспричинном обмороке,
ресусцитации после остановки жизни в анамнезе и расширении корня аорты,
присутствующими по одиночке или в комбинации (502). Наследственное происхождение ПМК должно быть объяснено
пациенту, что особенно важно в тех случаях, когда болезнь
ассоциируется с большим риском осложнений. При ПМК, как единственном диагнозе,
противопоказаний к беременности нет.
Бессимптомные пациенты с ПМК и
незначительной МР могут оцениваться клинически каждые 3 - 5 лет.
Эхокардиография в динамике не обязательна у большинства пациентов и
рекомендуется только пациентам, у которых выявляются признаки высокого риска при
первичной эхокардиографии, и пациентам, у которых появляются симптомы,
связанные с сердечно-сосудистыми заболеваниями, или у которых при осмотре
предполагается значительная МР. Пациенты, которые имеют высокий риск, включая
пациентов с умеренной и тяжелой МР, должны наблюдаться один раз в год.
Пациентам с тяжелой МР с симптомами или
нарушенной систолической функцией ЛЖ показано зондирование сердца, и для них
надо оценить операцию на МК (см. Раздел 3.6.4.2). Утолщенный, увеличенный МК
чаще может подвергаться пластике, чем
протезироваться, с низкой операционной
смертностью и с хорошими
непосредственными и отсроченными результатами (529 530). Текущие исследования
также сообщают о низком риске
тромбоэмболий и эндокардита при вальвулопластике по сравнению с протезированием клапана.
3.5.4. Хирургическое
лечение
Может потребоваться хирургическое лечение ПМК, особенно тем
пациентам, у которых появляется молотящая митральная створка вследствие разрыва
сухожильных хорд или их заметного удлинения.
Большинство таких клапанов может быть восстановлено успешно хирургами, опытными
в пластике МВ, особенно когда преимущественно затронута задняя створка МК. Пластика МК при МР
вследствие ПМК ассоциируется с хорошей отсроченной выживаемостью, которая
остается выше протезирования МК через 10 лет и через 20 лет после операции (529, 530). Пластика передней
створки МК ассоциируется с более высоким риском повторной операция для
последующей пластки задней створки. Как отмечено в Разделе 3.6.4.2, кардиологам
настоятельно рекомендуется направлять пациентов
кандидатов на
комплексную пластику МК в хирургические центры, имеющие опыт в выполнении
пластики МК. Остаточная МР ассоциируется с более высоким риском для повторной
операции
(530).
Симптомы сердечной недостаточности, тяжесть МР, наличие или отсутствие
фибрилляции предсердий, систолическая функция ЛЖ, конечный диастолический объем
ЛЖ и конечный систолический объем ЛЖ и давление в легочной артерии (в покое и
при нагрузке) – все это влияет на решение рекомендовать операцию на МК.
Рекомендации для операции у пациентов с ПМК и МР такиеже, и при других формах неишемической тяжелой МР. Для
уточнения деталей см. Раздел 7.3., операция на МК.
3.6. Митральная
регургитация
3.6.1. Этиология
Частые причины
органической МР включают синдром ПМК, ревматизм, ИБС, инфекционный эндокардит,
некоторые лекарственные препараты и заболевания соединительной ткани. МР может
также возникать вторичные из-за расширения фиброзного кольца вследствие
дилатации левого желудочка. В некоторых случаях, типа отрыва сухожильной хорды,
разрыва папиллярной мышцы или инфекционного эндокардита, МР может быть острой и
тяжелой. Напротив, МР может
прогрессировать
постепенно за длительный промежуток времени. Между этими крайностями МР может
иметь весьма различные клинические проявления.
3.6.2. Острая тяжелая
митральная недостаточность
3.6.2.1. Патофизиология
При острой тяжелой
МРвозникает внезапная перегрузка объемом левого предсердия и левого желудочка.
Острая перегрузка объемом увеличивает преднагрузку ЛЖ, умеренно увеличивая
общий ударный объем ЛЖ (531). Однако, в отсутствии
компенсаторной эксцентрической гипертрофии (которая не успевает
развиться) эффективный ударный объем и сердечный выброс уменьшаются. В то же
самое время, неподготовленные левое предсердие и левый желудочек не могут
приспособиться к объему регургитации, которая вызывает большой обратный поток в
левом предсердии и приводит к легочному застою. В этой фазе болезни, у пациента
уменьшается эффективный выброс (даже ударный) и
одновременно легочной
застой. При тяжелой МР нельзя допускать
гемодинамическую перегрузку и необходимо срочно провести пластику или
протезирование МК
.
3.6.2.2. Диагноз
Пациент с острым тяжелой
МР почти всегда выраженно симптомный. Осмотр прекардиальной области может
ввести в заблуждение,
потому что левый желудочек нормального размера и не вызывает усиленной
верхушечной пульсации. Систолический шум при МР может не быть голосистолическим
и может даже отсутствовать. Третий тон сердца или ранний диастолический шум
могут быть атипичной находкой при осмотре. Трансторакальная эхокардиография
может показать разрушение МК и обеспечить полуколичественную информацию
относительно тяжести повреждения; однако, трансторакальная эхокардиография
может недооценить тяжесть повреждения неадекватным отображением
цветного потока. Таким
образом, если есть гиперкинетическая систолическая функция левого желудочка при
трансторакальной эхокардиографии у пациента с острой сердечной
недостаточностью, может быть заподозрена тяжелая МР. Поскольку чрезпищеводная
эхокардиография может более точно оценить цветной поток (532), чрезпищеводная позиция
должна быть выполнена, если морфология МК и тяжесть регургитации все еще остаются под вопросом после
трансторакальной эхокардиографии. Чрезпищеводная эхокардиография также полезна
для уточнения анатомической
причины острой тяжелой
МР. и выбора оптимальной хирургической пластики.
У гемодинамически стабильного пациента,
если подозревается ИБС или есть факторы риска ИБС (см. Раздел 10.2)
необходимо перед
опреацией провести коронароангиографию, потому что у этих пациентов
реваскуляризация миокарда должна быть выполнена в течение операции на МК (533,534).
3.6.2.3. Медикаментозная
терапия
При острой тяжелой МР
медикаментозная терапия имеет ограниченную роль и нацелена прежде всего на
стабилизацию гемодинамики при подготовке к операции. Цель нехирургической
терапии состоит в том, чтобы уменьшить степень МР, в свою очередь увеличивая
эффективный выброс и уменьшая легочной застой. У нормотензивных пациентов применение нитропруссида поможет
эффективно достигнуть все 3 цели. Нитропруссид увеличивает эффективный выброс
не только за счет увеличения аортального потока, но также и за счет частичного
восстановления компетентности МК, уменьшая размеры ЛЖ (535,536). У пациента с гипотензией из-за резкого снижения
эффективного выброса нитропруссид не должен
применяться один, и
только в комбинации с инотропными препаратами (типа добутамина) он полезен у
некоторых пациентов. У таких пациентов аортальная баллонная контрпульсация увеличивает
эффективный выброс и среднее артериальное давление, уменьшая объем регургитации и давление наполнения ЛЖ,
и может использоваться для того, чтобы стабилизировать пациента при подготовке
к операции. Если инфекционный эндокардит является причиной острой МР,
идентификация и лечение инфекции обязательно.
3.6.3. Хроническая
бессимптомная митральная регургитация
3.6.3.1. Патофизиология
иестественное течение
Пациенты с МР от
незначительной до умеренной могут оставаться бессимптомными с небольшими гемодинамическими
компенсаторными изменениями или без них много лет; однако, МР при первичном
пороке МК имеет тенденцию прогрессировать в течение долгого времени с
увеличением перегрузки объемом из-за увеличения эффективной площади отверстия.
Прогрессирование МР может меняться и обусловлена прогрессированием порока или
размером митрального кольца (537).
Как только МР становится тяжелой,
развивается эксцентрическая гипертрофия ЛЖ, при которой новые саркомеры
устанавливаются последовательно, что увеличивает длину отдельных миокардиальных
волокон
(228 531).
Появляющееся увеличение конечного диастолического объема ЛЖ является
компенсаторным, потому что это дает возвожность повысить общий ударный объем,
что, в свою очередь, позволяет восстановить эффективеый сердечной выброс (538). В то же самое время,
увеличение размеров левого предсердия и ЛЖ позволяет приспособить объем
регургитации к более низкому давлению наполнении, и симптомы легочного застоя
уменьшаются. В этой фазе компенсации МР пациент может быть полностью
бессимптомным, даже в течение значительной нагрузки. Но необходимо отметить,
что в компенсаторной фазе увеличенная преднагрузка и уменьшенная или нормальная
постнагрузка (уменьшается регургитационная нагрузка на левое предсердие),
облегчают выброс ЛЖ, что приводит к большому общему ударному объему и
нормальному эффективному ударному объему.
Компенсаторная фаза МР является
непостоянной, но может продолжаться много лет. Однако, длительная перегрузка
объемом может в конечном счете привести к дисфункции ЛЖ. В этой фазе
сократительная дисфункция нарушает изгнание, и увеличивается конкчный
систолический объем. Это может привести к дальнейшей дилатации ЛЖ и увеличению
давления наполнения ЛЖ. Эти изменения гемодинамики приводят к уменьшению
эффективного выброса и легочному застою. Однако, все еще благоприятные условия
нагрузки часто поддерживают фракцию выброса на нижней границе нормы (0.50 -
0.60) несмотря на присутствие значительной миокардиальной дисфункции (531, 539, 540). Коррекция МР должна
быть выполнена перед наступлением фазы декомпенсации ЛЖ.
Многочисленные исследования показывают,
что пациенты с хронической тяжелой МР имеют высокую вероятность
прогрессирования симптомов или дисфункции ЛЖ в течение 6 - 10 лет (518,526,541,542). Однако, случаи внезапной смерти у бессимптомных
пациентов с нормальной функцией ЛЖ широко варьируют в этих исследованиях.
Сообщается о естественном течении тяжелой
МР вследствие молотящей задней створки (518). За 10 лет
90%
Пациентов умерли или
подверглись операции на МК. Смертность у пациентов с тяжелой МР, вызванной
молотящими створками составляет 6% - 7% ежегодно. Однако, пациенты с риском
смерти – это преимущественно те, которые имеют фракцию выброса меньше 0.60 или
с симптомами III–IV функционального класса
по NYHA, и, в меньшей степени, те, которые является
бессимптомными и имеют нормальную функцию ЛЖ (518, 543). Тяжелые симптомы также предсказывают плохой
результат после пластики или протезирования МК (543).
3.6.3.2. Диагноз
Анамнез крайне важен для
оценки пациента с хронической МР. Правильная первичная оценка толерантности к
физической нагрузке важна в выявлении незначительных изменений в симптомах при
последующих осмотрах. Осмотр выявляет смещение верхушечной пульсации ЛЖ,
которое свидетельствует, что МР является тяжелой и хронической, приводящей к
расширению сердца. Обычно обнаруживается третий тон сердца или ранний
диастолический шум, при этом дисфункция
ЛЖ может отсутствовать. Требуют повышенного внимания данные, указывающие на
легочную гипертензию, поскольку она присуща для запущенной болезни с плохим
прогнозом
(544). ЭКГ
и рентгенография грудной клетки полезны для оценки ритма и для уточнения
состояния малого круга и легочного застоя.
3.6.3.3. Показания для
трансторакальной эхокардиографии
Класс I
1. Трансторакальная
эхокардиография показана для базовой (первичной) оценки размеров и функции ЛЖ,
ПЖ и
размера левого
предсердия, давления в легочной артерии и тяжести МР (Таблица 4) любому пациенту, у
которого заподозрена МР. (Уровень доказанности: C)
2. Трансторакальная
эхокардиография показана для визуализации механизма МР. (Уровень
доказанности:B)
3. Трансторакальная
эхокардиография показана для ежегодного или полугодового наблюдения функции ЛЖ
(оцененка фракции выброса и конечного систолического размера) у бессимптомных
пациентов с умеренной и тяжелой МР. (Уровень доказанности: C)
4. Трансторакальная
эхокардиография показана пациентам с МР для оценки аппарата МК и функции ЛЖ
после изменениий в физикальных данных или симптомах. (Уровень доказанности:
C)
5. Трансторакальная
эхокардиография показана для оценки размеров и функции ЛЖ и гемодинамики МК
при
начальной оценки после
протезирования МК или пластики МК. (Уровень доказанности: C)
Класс IIa
Нагрузочная
допплерэхокардиография может быть показана бессимптомным пациентам с тяжелой МР
для оценки толерантности к физической нагрузке и эффекта воздействия нагрузки
на давление в легочной артерии и тяжесть МР. (Уровень доказанности: C)
Класс III
Трансторакальная
эхокардиография не показана для
рутинной динамической оценки
бессимптомных пациентов с легкой МР и нормальными размерами и систолической
функцией ЛЖ. (Уровень доказанности: C)
Первичное комплексное ультразвукопое
исследование (двумерная эохокардиография, допплерэхокардиография) является
обязательным для пациента с МР. Эхокардиография обеспечивает базовую оценку
размеров ЛЖ и левого предсердия, оценку фракции выброса и позволяет
приблизительно оценить тяжесть регургитации (2). Настоятельно рекомендуется количественная
оценка тяжести МР (Таблица 4) (27, 541, 545, 546). У большинства пациентов, оценка давления в
легочной артерии может быть получена посредством максимумальной скорости ТР (547). Изменения этих базовых
величин впоследствии используются для выбора времени операции МК. Артериальное
давление при каждом исследовании должно быть зарегистрировано, потому что
постнагрузка на желудочек будет влиять на определение тяжести МР.
Первичная трансторакальная
эхокардиография должна выявить анатомическую причину МР. Центральный цветной
поток МР со структурно нормальным
аппаратом МК предполагает наличие функциональной МР, которая может возникнуть
из-за расширения кольца вследствие дилатации ЛЖ или ограничена подвижнось
задней створки из-за локальной
дисфункции ЛЖ у пациентов с ИБС. Эксцентричный цветной потока МР с патологией аппарата МК указывает
на органическую МР. У пациентов с органической МР эхокардиография должна
оценить наличие кальция в кольце или в створках, увеличение створок клапана, и
вовлечение в процесс створок МК (передняя створка, задняя створка или обе
створки). Эти факторы помогают определять правильность восствновления клапана,
если операция была проведена. Система, предложенная Carpentier (548), позволяет эхокардиографистуr
сосредоточиться на анатомических и физиологических особенностях клапана, что помогает хирургу в планировании
пластики. Описание дисфункции клапана базируется на оценке движения свободного
края створки относительно плоскости кольца: тип I, нормальное; тип II,
увеличенное, как при ПМК; тип IIIA, ограниченное в течение систолы и диастлы, и
типа IIIB, ограниченное в течение систолы.
Диагноз тяжелой МР должен быть выставлен
согласованно с данными осмотра и комплексной двумерной эхокардиографии и
доплерэхокардиографии. Для диагностики тяжелой МР должны использоваться
многочисленные параметры доплерэхокардиографии (Таблица 4) (27), включая ширину и
площадь цветного потока, интенсивность
постоянно-волнового
допплеровского сигнала, контур легочного венозного потока, максимальную
скорость раннего митрального притока и
количественную оценку эффективной площади отверстия и объема регургитации (2). Кроме того, должно
быть оценено расширение левого желудочка и левого предсердия при хронической
тяжелой МР. Изменения аппарата МК часто
имеют место при тяжелой МР, но ишемическая дисфункция левого желудочка может
также приводить к тяжелой МР. Если возникают сомнения, или у пациента маленькое
окно при трансторакадльной эхокардиографии, для дальнейшей оценки тяжести МР
необходимы зондирование сердца, магнитная резонансная томография или
чрезпищеводная эхокардиография.
3.6.3.4. Показания для чрезпищеводной эхокардиографии
(См. также Раздел
8.1.4.)
Класс I
1. Дооперационная или
интраоперационная чрезпищеводная эхокардиография показана для определения
анатомической основы тяжелой МР у пациентов, которым рекомендована операция,
для оценки возможности и плана пластики. (Уровень доказанности: B)
2. Чрезпищеводная
эхокардиография показана для оценки МР пациентам, у которых трансторакальная
эхокардиография не обеспечивает диагностическую информацию относительно тяжести
МР, механизма МР и/или состояния функции ЛЖ. (Уровень доказанности: B)
Класс IIa
Дооперационная
чрезпищеводная эхокардиография может быть показана бессимптомным пациентам с
тяжелой МР, которыя являются
кандидатами на операцию, для оценки
выполнимости пластики. (Уровень доказанности: C)
Класс III
Чрезпищеводная
эхокардиография не показана для рутинного наблюдения бессимптомных пациентов с
МР естественного клапана (Уровень доказанности: C)
3.6.3.5. Динамическое
тестирование
Цель динамического
наблюдения пациента с МР состоит в субъективной оценке изменений в симптомном
статусе и в объективной оценке изменений в функции ЛЖ и в толерантности к
физической нагрузке, в том числе и при отсутствии симптомов. Бессимптомные пациенты
с легкой МР. и отсутствием признаков расширения ЛЖ, дисфункции ЛЖ или легочной
гипертензии могут наблюдаться ежегодно с инструкциями сразу обращаться к врачу
при появлении симптомов. Ежегодная эхокардиография не обязательна, если там нет
клинических признаков, что МР ухудшилась. У пациентов с умеренной МР,
клиническая оценка, включая эхокардиографию, должна быть выполнена ежегодно и
чаще, если возникают симптомы.
Бессимптомные пациенты с тяжелой МР
должны наблюдаться (анамнез, осмотр и эхокардиография) каждые 6 -12 месяцев с
оценкой симптомов или асимптомной дисфункции ЛЖ. Нагрузочное тестирование может использоваться для получения
дополнительных объективных данных о симптомах и изменениях в толерантности к
физической нагрузке. Нагрузочное тестирование является особенно важным если не
удается собрать подробный анамнез об объеме нагрузки, выполняемой пациентом.
Может быть полезным измерение давления в легочной артерии и оценка тяжести
МР в течение выпонения нагрузочного
теста.
Интерпретация фракции выброса ЛЖ у
пациента с МР весьма затруднительна, потому что нагрузочные условия при МР
облегчают изгнание и увеличивают фракцию выброса, стандарт измерения функции
ЛЖ. Тем не менее, несколько исследований показали, что дооперационная фракция выброса
является важным предиктором послеоперационной выживаемости у пациентов с
хронической МР (539,544,549–551). Фракция выброса у пациента с МР с нормальной
функцией ЛЖ обычно больше или равна 0.60. Согласно с этим, послеоперационная
желудочковая функция ниже, и выживание уменьшено у пациентов с дооперационной
фракцией выброса меньше 0.60 по сравнению с пациентами с более высокой фракцией
выброса
(550 551).
В качестве выбора или для общего
представления может использоваться эхокардиографическое измерение конечного
систолического размера (или объема) для выбора времени операции на МК. Конечный
систолический размер, который может быть меньше зависим от нагрузки чем фракция
выброса
(552),
должен быть меньше 40 мм до операции, чтобы гарантировать нормальную
послеоперационную функцию ЛЖ (538,551–553). Если пациенты становятся симптомными, они
должны подвергнуться операции на МК даже если функция ЛЖ является нормальной.
3.6.3.6. Руководство
по физической активности и нагрузке
Рекомендации
относительно участия в спортивных соревнованиях была издана Task Force on
Acquired Valvular Heart Disease of the 36th Bethesda Conference (138). Бессимптомные пациенты с МР любой тяжести, у
которых сохранен синусовый ритм, нормальные размеры ЛЖ и левого предсердия и
нормальное давление в легочной артерии, могут
тренироваться без
ограничения (138). Однако, бессимптомные пациенты с определенным расширением ЛЖ (больше или равно 60 мм),
легочной гипертензией или любой степенью систолической дисфункции ЛЖ в покое не
должны участвовать в любых спортивных соревнованиях.
3.6.3.7. Медикаментозная
терапия
У бессимптомных
пациентов с хронической МР нет общепринятой медикаментозной терапии. Хотя
интуитивно использование вазодилятаторов может казаться логичным по тем
причинам, что вазодидататоры эффективны при острой МР, нет больших долговременных исследований, указывающих на их пользу. Кроме того, потому
что МР с нормальной
Фракцией выброса является заболеванием, при котором
постнагрузка не увеличивается (230,538,554,555), препраты уменьшающие постнагрузку могут
вызвать физиологическое состояние
хронической низкой постнагрузки, которое пока еще очень мало изучено. В
небольших исследованиях ингибиторы АПФ не вызывали заметного улучшения объемов
ЛЖ и тяжести МР (312,556–558). Замеченный в некоторых исследованиях положительный эффект
быть может более связан с блокадой тканевого ангиотензина, а не с
вазодилатирующим эффектом препарата (559). Таким образом, в отсутствии системной гипертензии не известны
показания для использования вазодилататоров или ингибиторов АПФ у бессимптомных
пациентов с МР и сохраненной функцией ЛЖ.
Однако, у пациентов с функциональной или
ишемической МР (вследствие дилатационной или ишемической кардиомиопатии), есть
основания полагать, что уменьшение преднагрузки может быть полезным (535). Если есть систолическая дисфункция ЛЖ, начальное
лечение систолической дисфункции ЛЖ препаратами, такими как ингибиторы АПФ или
бета-блокаторы (особенно карведилол) и бивентрикулярная стимуляция уменьшают
тяжесть функциональной МР (560–563).
Для пациентов с МР, у которых возникают
симптомы, но функция ЛЖ сохранена, операция является самой соответствующей
терапия. Если появляется фибрилляция предсердий, частота сердечных сокращений
должна контролироваться урежающими ритм блокаторами кальциевых каналов,
бета-блокаторами, дигоксином, или, реже, амиодароном. У пациентов с тяжелой МР
и хронической фибрилляцией предсердий к пластике МК может быть добавлена процедура Maze (см. Раздел 3.6.4.2.4),
потому что это уменьшит риск послеопреационного инсульта. Хотя риск эмболии при
комбинации МР и фибрилляции предсердий прежде считался подобным таковому при МС
и фибрилляции предсердий, последующие исследования показали, что риск эмболии
может быть меньше при МР (564, 565). Тем не менее, рекомендуется, чтобы МНО был поддерживался
на уровне 2 - 3 у этих пациентов.
3.6.3.8. Показания для зондирования сердца
Класс I
1. Левая
вентрикулография и измерения гемодинамики показаны, когда неинвазивные тесты
являются неокончательными относительно тяжести МР, функции ЛЖ или необходима
операции. (Уровень доказанности: C)
2. Измерения
гемодинамики показаны, когда давление в легочной артерии непропорционально
тяжести МР по данным неинвазивных тестов. (Уровень доказанности: C)
3. Левая вентрикулография
и измерения гемодинамики показаны, когда есть несоответствие между клиническими
данными и данными неинвазивеых
исследований относительно тяжести МР. (Уровень доказанности: C)
4. Коронароангиография
показана перед пластикой МК или протезированием МК у пациентов с риском ИБС.
(Уровень доказанности:
C)
Класс III
Левая вентрикулография и
измерения гемодинамики не показаны
пациентах с МР, у которых не
рассматривается операция на клапане. (Уровень доказанности: C)
Зондирование сердца с или без нагрузки
необходимо, когда есть расхождения между клиническими данными и данными
неинвазивных исследований. Зондирование также выполняется, когда операция
рассматривается при сомнениях относительно тяжести МР. после неинвазивных
исследований, или когда есть необходимость оценить степень и тяжесть ИБС перед
операцией. У пациентов с МР, которые имеют факторы риска ИБС (например, пожилой
возраст, гиперхолестеринемия или гипертензия) или, когда есть подозрение, что МР ишемическая по происхождению
(инфаркт миокарда или предположительная ишемия), коронароангиография должна быть выполнена перед операцией.
Пациенты
обычно не подвергаются операции на клапане, если степень МР тяжелая.
Если есть разногласия относительно тяжести МР между пробой с физической
нагрузкой или элеменами всесторонней 2-мерной эхокардиографии,
допплерэхокардиографии, тогда проводятся чрезпищеводная эхокардиография,
магнитная резонансная томография или левая вентрикулография. Хотя стандартный
полуколичественный подход к определению тяжести МР методом вентрикулографии
ограничения
(566),
вентрикулография действительно дает
дополнительную информацию для оценки дилатации и функции ЛЖ и степени
тяжести МР. Измерение гемодинамики во время нагрузочного теста может принести
дополнительную информацию, возможно полезную при принятии решения.
При выполнении процедуры катетеризации,
может быть выполнено право-сердечное зондирование, если тяжесть МР не позволяет
уверенно определить давление в правых
полостях, для того, чтобы определить количественно повышение давления в левом предсердии (заклинивающее давление в
легочной артерии) и давление в легочной артерии. Наличие или отсутствие большой
v волны имеет небольшое диагностическое значение, когда оценивается в комбинации
с другими данными катетеризации (567).
3.6.4. Показания для операции
3.6.4.1. Типы операции
Три различных операции
на МК в настоящее время используются для коррекции МР: 1) пластика МК; 2)
протезировнаие МК с сохранением части или всего митрального аппарата; и 3)
протезирование МК с удалением митрального аппарата. Каждая процедура имеет свои
преимущества и недостатки, и поэтому показания для каждой процедуры отличаются.
В большинстве случаев, пластика МК
является операцией выбора в тех случаях, когда клапан является подходящим для
пластики при соответствующем хирургическом навыке и обрудовании. Эта процедура
сохраняет естественный клапан пациента без протеза и поэтому избегается риск
хронической антикоагуляции (кроме пациентов с фибрилляцией предсердий) или
недостаточности протеза в позднем послеоперационном периоде. И, кроме того,
сохранение митрального аппарата приводит к лучшей постлеоперационной функцию ЛЖ
и выживаемости, чем в случаях, в которых аппарат разрушен (545,568–573). Улучшение
послеоперационной функции происходит после пластики, потому что
митральный аппарат -
неотъемлемая часть левого желудочка, что существенно для
поддерживаниянормальной формы, объема и функции левого желудочка (574). Однако, пластика МК
технически более требовательна, чем протезирование МК, может требовать более
длительного времени искусственного кровообращения, и может иногда терпеть
неудачу. Морфология клапана и хирургический опыт имеют критическое значение для
успеха пластики клапана (см. ниже).
Частота повторной операции после пластики
МК подобна частоте повторной операции после протезирования МК (530).
У пациентов,
подвергнувшихся пластике МК, с тяжелой возвратной МР частота повторной операции
составляет 7%-10% за10 лет (530,575–578). Приблизительно 70 % возвратной МР, как
полагают, появляются вследствии первичной операции и 30 % вследствие
прогессирования клапанного порока (575). Частота повторной операции ниже у тех
пациентов, у кого первичная операция проводилась на деформированной задней
створке, по сравнению с пациентами с
двумя деформированными створками или с передней деформированной створкой (518 577).
Преимущество протезирования МК с
сохранением связочного аппарата, потому что эта операция гарантирует
послеоперационную компетентность МК, сохранность функции ЛЖ и увеличивает послеоперационную
выживаемость по сравнению с протезированием МК разрушением аппарата (570,579–582). Отрицательные стороны
использования клапанного протеза заключаются в риске повреждения естственной
ткани клапана и потребности в антикоагуляция.
Протезирование МК, при котором аппарат МК удаляется, почти не
должен выполняться. Оно должно выполгяться только в том случае, когда родной
клапан и аппарат столь деформированы дооперационной патологией (ревматизм,
например), что митральный аппарат не может быть сохранен. Как отмечалось ранее
(Раздел 3.4.9), искусственная хордальная реконструкция действительно расширяет
возможности пластики у некоторых таких пациентов с ревматической МР (467,468).
Преимущества пластики МК делают ее
применимой при полном спектре МР, включая обе границы спектра. Пластика клапана
может быть возможна у пациентов с сильно выраженной симптоматикой МР и
сниженной функцией ЛЖ,
потому что это сохраняет
функцию ЛЖ на дооперационном уровне (572). Протезирование МК с разрушением аппарата у
таких пациентов может
привести к ухудшению функции ЛЖ
или даже к фатальной дисфункции
ЛЖ после операции. С другой стороны, у
относительно бессимптомного пациента с хорошо сохранившейся функцией ЛЖ
пластика клапана с тяжелой регургитацией
может быть рассмотрена во избежание начала желудочковой дисфункции от
длительной перегрузки объемом (583). Однако, неудавшаяся пластика МК приводит к необходимости в
протезировании клапана;
что является само-собой
осложнением, потому что добавляется
риск протезирования для пациента, которыму предварительно не требовалось
протезирование. Следовательно, "профилактическая" операция у
бессимптомного пациента с МР и нормальной функции ЛЖ требует высокой
вероятности успешной пластики.
3.6.4.2. Показания для
операции на митральном клапане
Класс I
1. Операция на МК
рекомендуется симптомному пациенту с острой тяжелой МР. * (Уровень
доказанности: B)
2. Операция на МК
показана пациентам с хронической тяжелой МР* и симптомами II, III, или IV
функционального класса по NYHA в отсутствии тяжелой
дисфункции (тяжелая дисфункция ЛЖ определена как фракция выброса меньше 0.30)
и/или конечного систолического размера больше 55 мм. (Уровень доказанности:
B)
3. Операция на МК
показана бессимптомным пациентам с хронической тяжелой МР* и от легкой к
умеренной
дисфункции ЛЖ, фракция
изгнания 0.30- 0.60, и/или конечном систолическом размере больше или равный 40
мм. (Уровень
доказанности: B)
4. Пластика МК
рекомендуется при протезировании МК у
большинства пациентов с тяжелой хронической MR*, которым требуется операция, и
пациенты должны быть направлены в хирургические центры, опытные в пластике МК. (Уровень доказанности:
C)
Класс IIa
1. Пластика МК может
быть рекомендована в опытных хирургических центрах бессимптомным пациентам с
хронической тяжелой МР* с сохраненной функцией ЛЖ (фракция изгнания больше 0.60
и конечный систолический размер меньше 40 мм), у кого вероятность успешной
пластики без остаточной МР больше 90 %. (Уровень доказанности: B)
2. Операция на МК может
быть рекомендована бессимптомным пациентам с хронической тяжелой МР, *
сохраненной функцией ЛЖ и с впервые появившейся фибрилляцией предсердий.
(Уровень доказанности: C)
3. Операция на МК может
быть рекомендована бессимптомным пациентам с хронической тяжелой МР, *
сохраненной функцией ЛЖ, и с легочной гипертензией (систолическое давление в
легочная артерии больше 50 мм в покое или больше 60 мм при нагрузке.
(Уровень доказанности: C)
4. Операция на МК может
быть рекомендована пациентам с хронической тяжелой МР* вследствие
первичного дефекта митрального аппарата и симптомами III–IV функционального класса
по NYHA и тяжелой дисфункции ЛЖ (фракция выброса
меньше 0.30 и/или конечный систолический размер больше 55 мм), у которых
пластика МК весьма вероятна. (Уровень доказанности: C)
Класс IIb
Пластика МК может быть
рассмотрена у пациентов с хронической
тяжелой вторичной МР* вследствие
тяжелой дисфункции ЛЖ (фракция выброса меньше 0.30), у которых
постоянные симптомы III-IV функционального класса по NYHA несмотря на оптимальную
терапию сердечной недостаточности, включая
бивентрикулярную
стимуляцию. (Уровень доказанности: C)
Класс III
1. Операция на МК не
обозначена для бессимптомных пациентов с МР и сохраненной функцией ДЖ (фракция выброса больше 0.60 и конечный систолический размер меньше
40 мм), у кого есть существенное
сомнение относительно выполнимости пластики. (Уровень доказанности: C)
2. Изолированная
операция МК не обозначена для пациентов с незначительной или умеренной МР
(Уровень доказанности: C)
*См Таблицу 4 (27).
Во многих случаях, тип
операции, пластика МК и протезирование, является важным в выборе времени
операции. Фактически, хотя тип операции, которая будет выполнена, не всегда
может быть установлена до операции, много признаков могут предсказать операцию,
которая может быть выполнена. Это предсказание основано на навыках и опыте
Хирурга, выполняющего протезирование, на
местоположение и типе болезни МК, которая приаела к МР.
Неревматический
пролапс задней створки МК из-за дегенеративного процесса МК или
разорванные хорды могут обычно быть восстановлены рассечением части клапана и аннулопластикой (584 585). Причастность передней створки или передней и
задней створок уменьшают вероятность пластики, потому что операция требует
другого
вмешательства, типа
связочного сокращения, связочной передачи и инновационной анатомической
пластики (586–591). Следовательно, навыки
и опыт хирурга вероятно самые важные детерминанты возможной операции, которая
будет выполнена. Вообще, ревматическая причастность МК и кальциноз МК, створок или кольца уменьшают вероятность
пластики, даже в опытных руках (592).
Число пациентов, подвергающихся пластике
МК при МР увеличилось устойчиво за прошлое десятилетие в Объединенном
Королевстве и в Канаде относительно числа протезирования МК. Однако, среди
изолированных процедур МК, сообщенных в STS Национальной Сердечной Базой данных
с 1999 по 2000 (593), частота пластики была только 35.7 % (3027 из в общей сложности
8486 процедур), т.е. пластика МК недостаточно использовалось. STS Национальная
База данных также указывает смертность менее чем 2 % у пациентов, подвергшихся
изолированной пластике МК в 2004,
которая сравнивается с
больше чем 6%-ой смертностью для пациентов, подвергнувшихся изолированному
протезированию МК (165). Учитывая благоприятное воздействие восстанавления МК на
выживании и функцию ЛЖ, кардиологам настоятельно рекомендуется направлять на
пластику МК в хирургические центры, имеющие опыт в выполнении пластики МК.
3.6.4.2.1. СИМПТОМНЫЕ ПАЦИЕНТЫ С
НОРМАЛЬНОЙ ФУНКЦИЕЙ ЛЕВОГО ЖЕЛУДОЧКА.
Пациенты с явными признаками сердечной
недостаточности, несмотря на нормальную функцию ЛЖ на эхокардиографии (фракция
выброса больше 0.60 и конечный систолический размер меньше 40 мм), подлежат
операции.
Операция должна быть
выполнена у пациентов с умеренными симптомами и тяжелой МР (рис. 8), особенно, если это
пластика МК, а не протезирование. Возможность пластики зависит от нескольких
факторов, включая анатомию клапана и хирургическую экспертизу. Успешная
хирургическая пластика улучшает симптомы, сохраняет функцию ЛЖ и лишена
проблем протезного
клапана. Когда пластика не выполнима, протезирование МК с сохранением связок
должно
уменьшить симптомы и
поддержать функцию ЛЖ.
3.6.4.2.2. БЕССИМПТОМНЫЕ ИЛИ СИМПТОМНЫЕ ПАЦИЕНТЫ С
ДИСФУНКЦИЕЙ ЛЕВОГО ЖЕЛУДОЧКА.
Предоперационные показатели, которые
являются прогнозирующими для послеоперационного выживания, симптомного улучшения и послеоперационной функции ЛЖ суммированы в
таблице
21 (538,539,544,549–552). Выбор времени операции для бессимптомных пациентов спорен, но
большинство сейчас приходят к выводу, что операция на МК показана при появлении эхокардиографических
признаков дисфункции ЛЖ. Они включают:
фракцию выброса ЛЖ меньше или равной
0.60 и/или конечный систолический размер ЛЖ больше или равный 40 мм (рис. 8). Операция, выполненная в это время вероятно предотвратит дальнейшее
ухудшение функции ЛЖ и продлит жизнь. Это будет вероятно или пластика или протезирование (551), хотя пластика явно
предпочтительней. Необходимо подчеркнуть, что
в отличие от выбора времени ПАК
для АР у пациентов с хронической
МР, фракция выброса ЛЖ не должна быть
ниже нормальных величин (551,594–596). Данные относительно послеоперационной выживаемости намного
более сильно связаны с фракцией изгнания ЛЖ, чем с конечным систолическим
размером ЛЖ (544,549–551), тогда, как и фракция
выброса и конечный систолический размер строго влияют на послеоперационную
функцию ЛЖ и сердечную недостаточность (538,539,544,551,552). Операцию на МК можно
также рекомендовать симптоматическим пациентам с проявлениями систолической дисфункции ЛЖ (фракция выброса
меньше или равна 0.60, и/или конечный
систолический размер больше или равный
40 мм).
Определение кандидатуры на операцию
симптомного пациента с МР и достаточно
выраженной дисфункцией -
общая клиническая
дилемма. Вопрос, который часто возникает: имеет ли пациент с МР. такую
измененную дисфункцию ДЖ, что он уже больше не кандидат на операцию? Часто такие случаи представляют трудность в
дифференциации
первичной кардиомиопатии
со вторичной МР. от первичной МР с вторичной дисфункцией миокарда. В последнем
случай, если пластика МК
кажется вероятной, операция должна быть
все же рассмотрена (рис. 8). Даже в том случае, если у такого пациента возможна постоянная
дисфункция ЛЖ, операция, вероятно, улучшит симптомы и предотвратит дальнейшее
ухудшение функции ЛЖ (328). Если протезирование МК необходимо у таких пациентов, оно должно
быть выполнено только в том случае, если связочный аппарат может быть сохранен.
Модификация геометрии МК "карликовым" (“undersized”) кольцевым обручем у
пациентов с тяжелой дисфункцией и значительной функциональной МР может быть
успешной в подгруппе пациентов с первичной болезнью миокарда (597–602), хотя воздействие на
прогноз, в этом случае, сравнимо с
агрессивной медикаментозной терапией, включая бета-блокаторы и сердечную
ре-синхронизационную терапию (560–563), но это не было изучено в проспективном рандомизированном
исследовании.
3.6.4.2.3. Бессимптомные
пациенты с нормальной функцией левого желудочка.
Как отмечалось ранее,
пластика тяжелой регургитации клапана может быть рассмотрена у бессимптомных
пациентов с тяжелой МР. и нормальной функцией ЛЖ для того, чтобы сохранить
размеры и функцию ЛЖ и предотвратить осложнения хронической тяжелой МР. (541). Хотя нет рандомизированных данных, чтобы
рекомендовать этот подход ко всем пациентам, комитет признает, что некоторые
опытные центры рекомендуются в этом руководстве пациентам, у которых вероятность успешной пластики высока.
Анамнез указывает однозначно, что бессимптомные пациенты с тяжелой МР и
нормальной функцией ЛЖ имеют высокую вероятность развития симптомов и/или
дисфункции ЛЖ, которые гарантируют операцию в течение 6 - 10 лет (518,526,541,542). Два недавних исследования также обратились
к риску внезапной смерти (541 542) у бессимптомных
пациентов с тяжелой МР и нормальной функции ЛЖ. В долгосрочном ретроспективном
исследовании, в котором
была определена допплерэхокардиографически количественно тяжесть МР (541), 198 пациентов с эффективной площадью отверстия
больше 40 mm2 имели 4 % ежегодно риск
сердечной смерти в течение среднего последующего периода 2.7 года. Однако, во
втором исследовании 132 пациента, наблюдавшиеся на протяжении 5 лет, в течение которых показателями для
операции были симптомы, развитие дисфункции ЛЖ (фракция выброса меньше 0.60),
дилатация ЛЖ (конечный систолический размер ЛЖ больше 45 мм), фибрилляция предсердий, или легочная гипертензия. Была
только 1 сердечная смерть у бессимптомного пациента, но этот пациент отказался
от операции, которая была показана при появлении дилатации ЛЖ (542).
Пластика МК часто рекомендуется
гемодинамически стабильным пациентам с недавно приобретенной тяжелой МР, такой
как при разрыве хорд. Операция также рекомендуется бессимптомным пациентам с
хронической МР с
недавно возникшей
фибрилляцией предсердий, у которых есть высокая вероятность успешной пластики
клапана (см. ниже).
Операцию для бессимптомных пациентов с тяжелой МР и нормальной функцией ЛЖ
нужно рассматривать только, если есть больше чем 90%-ая вероятность успешной
пластики клапана в центре, специализирующемся на этой процедуре. Как отмечено
выше, кардиологам настоятельно рекомендуется направлять пациентов, которые
являются кандидатами на пластику МК в хирургические центры, специализирующиеся
на пластике МК.
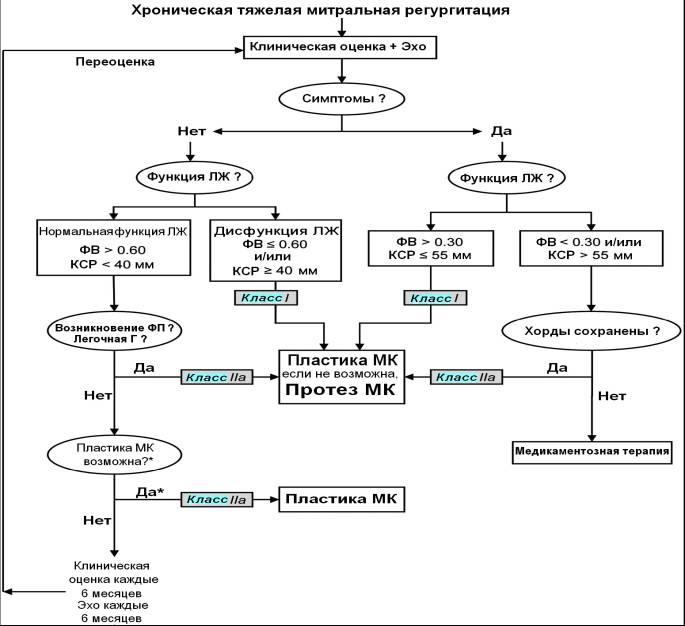
Рис 8.